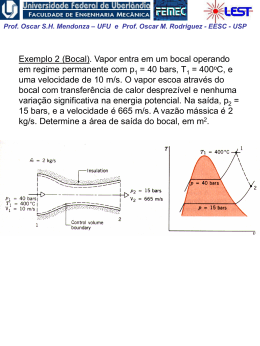
Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Variação de Entropia em Processos Reversíveis Q s2 s1 T rev. 1 2 Podemos constatar que, se o processo é reversível e adiabático ds q 0 0 Para processos reversíveis: q T .ds Portanto, o calor num diagrama T-s pode ser visualizado, como a área abaixo de um processo reversível. 2 T ve rs ív el T re q=Tds 1 ds s Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Façamos uma análise restrita a: 1. Processo reversível 2. Motor térmico 3. Ciclo de Carnot 1. dois processos isotérmicos reversíveis 2. dois processos adiabáticos reversíveis Ciclo de Carnot no diagrama Temperatura Entropia (T x S): W QL O rendimento do ciclo pode ser expresso em termos de áreas: térmico Wlíq QH área 1 - 2 - 3 - 4 - 1 área 1 - 2 - b - a - 1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Processos: • 1-2, transferência de calor positiva isotérmica (do reservatório de alta temperatura, TH, para o fluido de trabalho) 2 2 Q 1 S 2 S1 T rev TH 1 Q2 Q TH 1 1 a entropia do sistema aumenta. • 2-3, processo adiabático reversível dS Q 0 T rev o processo é adiabático, portanto a entropia permanece constante. Este é um processo isoentrópico e a temperatura do fluido de trabalho atinge TL • 3-4, transferência de calor negativa isotérmica (do fluido de trabalho para o reservatório de baixa temperatura, TH. 4 S 4 S3 Q 1 T rev TL 3 2 1 Q Q4 TL 3 a entropia do sistema diminui. • 4-1, processo adiabático reversível, e portanto isoentrópico Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Considerando os processos reversíveis de transferência de calor, analisamos um processo 1-2 de mudança de estado de líquido para vapor saturado no diagrama T x s: Como trata-se de um processo a pressão constante, da definição de entalpia, o calor transferido por unidade de massa é igual a hlv , assim: 2 2 hlv 1 Q 1 1 q2 s2 s1 slv Q m 1 T mT 1 T T rev Obs.: verifique nas tabelas termodinâmicas a relação entre a variação da entropia e variação da entalpia descrita acima. Se continuamos transferindo calor a pressão constante ao vapor saturado, temos: 3 3 1 Q Tds 2 q3 m2 2 mas: 2 É necessário conhecer a relação entre T e s, pois T não é cte. q3 área 2 - 3 - c - b - 2 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Exemplo 1: Água inicialmente como líquido saturado a 100oC está contida num conjunto êmbolo-cilindro. A água realiza um processo ao estado correspondente de vapor saturado, durante o qual o êmbolo move-se livremente no cilindro. Se a mudança de estado ocorre através do aquecimento da água num processo internamente reversível a pressão e temperatura constantes, determine o trabalho e a transferência de calor por unidade de massa, ambos em kJ/kg. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Duas relações termodinâmicas importantes Equações de Gibbs: TdS dU pdV TdS dH Vdp 1a Lei : Q dU W (1) Q TdS W pdV (2) H U pV dH dU pdV Vdp substitui- se em (1) A integração deve ser realizada ao longo de um caminho reversível, porém as equações de Gibbs podem ser aplicadas a um processo irreversível, pois lida-se apenas com propriedades termodinâmicas. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Variação de entropia de um gás perfeito Da 1ª equação de Gibbs: Tds du pdv Para um gás perfeito: du cvo dT e RT p v Assim: dT Rdv ds cvo T v Integrando: 2 dT v2 s2 s1 cvo R ln T v1 1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Analogamente, da 2ª equação de Gibbs: Tds dh vdp Para um gás perfeito: RT dh c po dT e v p Assim: ds c po dT Rdp T p Integrando: 2 s2 s1 c po 1 dT p2 R ln T p1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Para integrar as equações acima, devemos conhecer as relações entre calores específicos e a temperatura. 1- Calores específicos constantes: T2 p2 s2 s1 c po ln R ln T1 p1 e T2 v2 s2 s1 cvo ln R ln T1 v1 2- Equações ajustadas empiricamente para cpo (Tab. A.6): 3- Integração dos cálculos da termodinâmica estatística (Tabs. A.7 e A.8): T s o T Assim c po T dT To p2 s2 s1 s s R ln p1 o T2 (+) o T1 Portanto, temos três possibilidades para avaliar c po : 3- Tabelas de gás ideal 2- Equações empíricas precisão (-) 1- Calor específico constante Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Processo politrópico reversível para gás perfeito Para processo reversível, adiabático, i.e., isoentrópico, com cpo = cte: ou T2 p2 s2 s1 0 c po ln R ln T1 p1 T2 R p2 ln ln T1 c po p1 e T2 p2 T1 p1 mas: R c po c po cvo k 1 R c po c po k onde: k Assim: T2 p2 T1 p1 k 1 k pvk cte. c po cvo T2 v1 T1 v2 k 1 p2 v1 p1 v2 k Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Relembrando que para processo politrópico de gás ideal: pV n cte. ou p2 V1 p1 V2 e n 1 / n T2 p2 T1 p1 e W 2 1 2 W 1 n V1 V2 n 1 mR T2 T1 n 1 pd V 1 n V2 n 1 pd V mRT ln V1 Portanto: • Processo isotérmico (T = cte.): • Processo isobárico (p = cte.): • Processo isocórico (v = cte.): • Processo isoentrópico (s = cte.): pv = cte; n = 1 pv0 = cte; n = 0 pvºº = cte; n = ∞ pvk = cte; n = k Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Exemplo 2 Ar realiza um processo isentrópico de p1 = 1 bar, T1 = 300 K até um estado final onde a temperatura é T2 = 650 K. Empregando o modelo do gás ideal, determine a pressão final p2, em bar. Resolva usando (a) dados de da tabela sT0 A.7 (van Wylen, 6a ed.) e (b) razão de calores específicos constante, k avaliada na temperatura ambiente (Tab. A.5).
Baixar