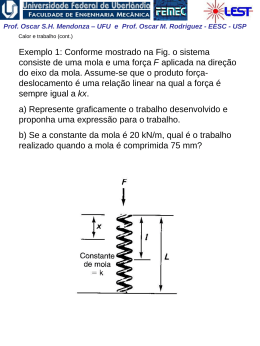
Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Calor e Trabalho Definição de trabalho mecânico: “produto escalar de uma força aplicada sobre um corpo ou sistema pelo deslocamento” 2 W F dx 1 requerida a relação funcional entre força e trabalho Definição termodinâmica de trabalho: “Trabalho é realizado por um sistema se o único efeito sobre os arredores possibilitar o levantamento de um peso” Definição do sinal do trabalho: • (+) W é o trabalho feito pelo sistema (sistema perde energia) • (-) W é o trabalho feito sobre o sistema (sistema ganha energia) Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Suponha um sistema composto por fluido cujos limites são adiabáticos (sistema isolado). Em (b), a polia gira pela ação da queda de um peso e, como consequência, ocorre o aquecimento do fluido no sistema isolado (aumenta a temperatura). Houve transferência de calor? Em (a), substituindo-se o sistema isolado por outra polia, fica claro que o único efeito externo da iteração dos dois sistemas seria levantar o peso; trata-se, portanto, de trabalho. Qualquer processo que envolve só iterações de trabalho é definido como processo adiabático. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Trabalho Abiabático: Energia Potencial O trabalho necessário para mudar a posição de um corpo num caqmpo gravitacional: F m.g mg wad mg dz ad = adiabático Integrando: Wad m.g.(Z2 Z1 ) Ep Eenergia potencial gravitacional Ep Wad Temos então a energia potencial gravitacional, a qual é independente do processo realizado. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Trabalho adiabático: Energia Cinética O trabalho necessário para mudar a quantidade de movimento de um corpo,num campo de velocidades: dv F ma m dt ds v dt dv Wad m . vdt mv .dv dt Integrando: m 2 2 Wad v2 v1 c 2 Temos então a energia cinética, a qual é independente do processo realizado. Wad dU d m kT Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Trabalho adiabático: Energia interna O trabalho necessário para mudar a energia sensível de um corpo: A integração de forças de natureza microscópica (forças de fusão nuclear, forças eletrostáticas, forças de atração mássica, forças de inércia ) relacionadas a um Campo de Temperaturas na forma de energias associadas é chamada de energia interna (u) Supondo que a energia interna é apenas função da temperatura (normalmente um fato com gases ideais): Wad dU d m kT Integrando: Wad U mk T2 T1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Portanto: Limite adiabático exclui qualquer iteração que não seja trabalho (isola o sistema). A lei de Newton combinada com o conceito de processo adiabático, permite obter as formas mecânicas da energia. energia total (E) de um sistema, será a somatória dos trabalhos adiabáticos realizados ou recebidos pelo sistema Etotal = E interna + E cinética + Epotencial + Eeletrostática + Emagnética + .... O conceito de trabalho freqüentemente está relacionado a formas específicas de uma quantidade chamada energia. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Interações entre Trabalho e Calor Trabalho realizado pela fronteira móvel de um sistema simples compressível em um processo quase-estático (composto por estados termodinâmicos de equilíbrio) O processo quase estático é um processo ideal e pode ser imaginado se retirarmos gradativamente pesos de massa infinitesimalmente pequena do pistão W pAdL ou W pdV É necessário conhecer a relação entre pressão e volume! Conceito importante: Trabalho só pode ser identificado nas fronteiras do sistema. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Considerando como sistema o gás, contido num cilindro com êmbolo, sofrendo um processo de expansão quaseestático: 2 2 W2 W 1 1 pdV 1 (-) Trabalho realizado sobre o sistema (+) Trabalho realizado pelo sistema Podemos visualizar o trabalho realizado como a área debaixo do processo Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Verificamos através do gráfico acima que trabalho é função do caminho. Assim, trabalho é uma função de linha. Em outras palavras, W é uma diferencial inexata. Propriedades termodinâmicas são funções de ponto, ou diferenciais exatas. Elas não dependem do caminho, ou seja 2 dV V 2 V1 : é usado para diferenciais inexatas (como trabalho) 1 d: é usado para diferenciais exatas (como volume) Para trabalho, escrevemos: 2 W 1 1W2 W2 W1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Há duas classes de problemas para a determinação de 2 W2 1 pdV 1 1. Soluções gráficas, e 2. Relações funcionais entre p e V. Neste caso, um exemplo é o processo politrópico, onde: P V n cte Esta solução não é válida para n = 1. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Trabalho em processos quase - estáticos realizados por gás ideal Processo isotérmico (T = cte):valido para gases ideais ou qualquer gas com coeficiente de compressibilidade diferente da unidade pV cte. p1V1 p2V2 cte. p1v1 p2v2 cte. w12 2 1 2 dv cte dv cte 1 v v w12 p1v1 ln(v2 / v1 ) RT1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Processo isobárico (Pressão = cte.):valido para gas ideal ou qualquer gas ou fluido compressivel RT1 RT2 p1 p2 cte v1 v2 pv0 cte. w12 ctedv p1 v2 v1 . 2 1 Qualquer processo realizado por um gás seja ideal ou não, pode ser representado por uma equação simples num diagrama p-v, isto é: pvn cte. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Portanto: • Processo isotérmico(qualquer gás ): • Processo isobárico(qualquer gás): • Processo isocórico(qualquer gás): pv = cte; n = 1 pv° = cte; n = 0 pvºº = cte; n = 8 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Problema ilustrativo Para o processo pv = cte, uma compressão de gás é desenvolvida de uma pressão inicial de 200 kPa até uma final de 800 kPa. Se o volume específico inicial é 0,1 m3/Kg, (a) determine o trabalho por quilo de gás; (b) Avalie este problema graficamente (área sob a curva pressão-volume) processo a pv=cte Dados: p1=200 "kpa" p2=800"kpa" v1=0,1"m^3/kg" Equações: p1*v1=p2*v2 W=p1*v1*ln(v2/v1) Resposta: Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP 0 800 750 -5 700 650 -10 550 W12 p2 600 -15 500 450 -20 400 350 -25 300 250 -30 200 0,02 0,03 0,04 0,05 0,06 v2 0,07 0,08 0,09 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP
Baixar