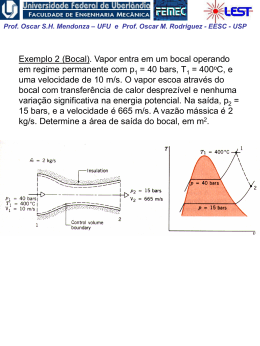
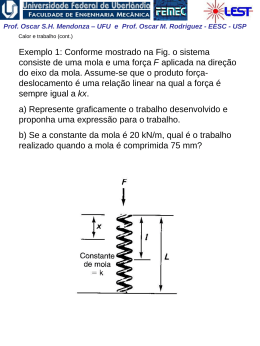
Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Variação de Entropia do Sistema Durante um Processo Irreversível Aplicando a desigualdade de Clausius: 2 S 2 S1 1 Q dS Q T (1a) (1b) T • Esta equação demonstra a influência da irreversibilidade na entropia de um sistema. • Se durante a transferência da quantidade de calor Q para o sistema à temperatura T ocorrerem efeitos irreversíveis, a variação da entropia será maior do que a do processo reversível. • As irreversibilidades influenciam no sentido de aumentar a entropia do sistema. Como exemplo, o diagrama T x s de um processo ocorrendo numa turbina adiabática e reversível e numa turbina real: Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Geração de Entropia (trabalho perdido) De modo a obter uma expressão para a variação da entropia para um processo irreversível que envolva uma igualdade e não uma desigualdade (Eq. 1a), podemos escrever: dS onde: Q T 2 S ger ou S Q T S 1 2, ger (2) 1 S ger 0 = para processos reversíveis > para processos irreversíveis Da Eq. (2), temos que a transferência de calor em processo irreversível é menor do que aquela do processo reversível: Qirr TdS TS ger Utilizando a 1a lei da termodinâmica, temos que o trabalho em processo irreversível também é menor do que aquele que o do processo reversível: Wirr pdV TS ger Trabalho perdido Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Observações quanto à geração de entropia: 1. Há 2 formas de aumentar a entropia de um sistema: 1. Transferência de calor para o sistema 2. O sistema realizar um processo irreversível 2. Há apenas uma forma possível de diminuir a entropia de uma sistema: transferência de calor do sistema (geração de entropia não pode ser negativa) 3. Para um processo adiabático, Q 0 , o incremento de entropia é sempre associado às irreversibilidades. 4. Considerando os gráficos p x V e T x S, a área abaixo das linhas relacionadas aos processos irreversíveis nunca representarão trabalho ou calor (linhas pontilhadas). Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Exemplo 3: Água inicialmente como líquido saturado a 100oC está contida num conjunto êmbolo-cilindro. A água realiza um processo ao estado correspondente de vapor saturado, durante o qual o êmbolo move-se livremente no cilindro. Não há transferência de calor com a vizinhança. Se a mudança de estado ocorre devido a ação de um agitador, (a) determine o trabalho por unidade de massa, ambos em kJ / kg; e (b) a quantidade de entropia produzida por unidade de massa em kJ / kg K. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Exemplo 4: Durante uma operação em regime permanente, uma caixa de transmissão de eixos paralelos recebe 600 kW pelo eixo de alta velocidade, mas devido a fricção e outras irreversibilidades entrega apenas 588 kW pelo eixo de baixa velocidade. A caixa de transmissão é arrefecida na sua superfície externa de acordo com Q hATb To onde h é o coeficiente de transferência de calor, A é a área da superfície externa, Tb é a temperatura uniforme da superfície externa, e To é a temperatura uniforme da vizinhança distante da vizinhança imediata da caixa de transmissão. Avalie a taxa de geração de entropia, , em kW / K, (a) a caixa de transmissão como o sistema e (b) um 1 S 2para , ger sistema maior consistindo da caixa de transmissão e o suficiente de sua vizinhança para a transferência de calor ocorrer a temperatura To. Considere h = 0,17 kW / m2 K, A = 1,8 m2 e To = 293 K. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Princípio do Aumento da Entropia Consideremos agora um universo constituído por um sistema e o meio: Temos para o sistema que, da Eq. (1a) : dSsistema Q T Para o meio (reversível por definição), temos que: dSmeio Q To geração de entropia Portanto a variação líquida de entropia é: dSuniverso dSsistema dSmeio 1 1 Q T To Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Assim: 1 1 dS UNIV Q T T0 Q T0 dS UNIV 1 T0 T ou: Como To > T , (To / T – 1) será sempre positivo. Concluímos que: dSUNIV dSsistema dSmeio 0 ou dSUNIV dS sistema dS meio S ger 0 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Um outra interpretação considera um balanço de entropia num sistema isolado. Da Eq. (2), temos que: =0 2 Ssistema isolado Q T S 1 2, ger 1 ou: Ssistema isolado 1 S 2, ger 0 Esta equação dita a única direção na qual qualquer processo pode ocorrer O princípio do aumento da entropia pode ser considerado como uma afirmação geral quantitativa da segunda lei da termodinâmica do ponto de vista macroscópico. Do ponto de vista microscópico, podemos dizer que os únicos processos que um sistema isolado pode realizar são aqueles que aumentam a “desordem” do sistema. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Variação de entropia de um sólido ou líquido Temos para sólidos e líquidos que: dh du cdT Da equações de Gibbs: 0 Tds dh vdp dh du c ds dT T T T Como mencionado no Cap. 5, podemos considerar o calor específico constante em muitos processos que envolvem sólidos ou líquidos; assim: T2 s 2 s1 c ln T1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Exemplo 5: Uma barra de metal (0,3 kg) inicialmente a 1200 K é removida de um forno e passa por um processo de têmpera por imersão em um tanque isolado contendo 9 kg de água inicialmente a 300 K. Ambas substâncias podem ser modeladas como incompressíveis. Adote calores específicos constantes cw = 4,2 kJ / kg K e cm = 0,42 kJ / kg K para a água e barra, respectivamente. A transferência de calor do tanque pode ser desprezada. Determine (a) a temperatura final de equilíbrio do metal é da água, em K, e (b) a quantidade de entropia gerada, em kJ / K.
Baixar