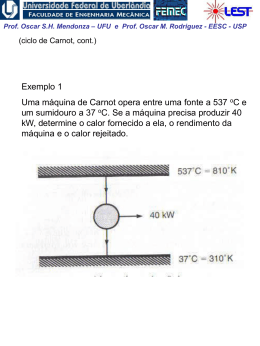
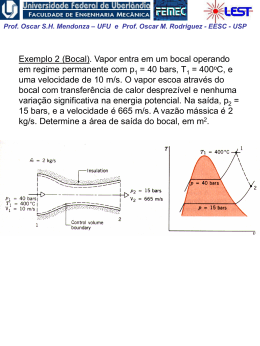
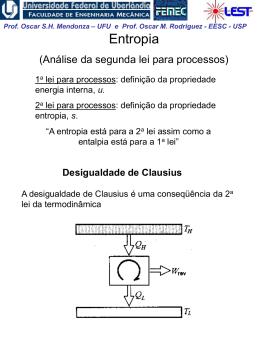
Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP A Energia Interna, Entalpia e Calor Específico de Gases Perfeitos Experiência de Joule em 1843 Um experimento clássico da termodinâmica: o recipiente A, com ar, e o B, evacuado, estão em equilíbrio térmico submergidos em água. Abre-se a válvula e assim iguala-se a pressão em A e B. Não se observou nenhuma mudança na temperatura da água, portanto, não houve transferência de calor para o ar. Como o trabalho foi nulo, da 1ª lei percebe-se que não houve mudança na energia interna do ar com a variação de pressão e volume. Joule concluiu que a energia interna é independente da pressão e do volume. Para gás ideal: Assim: u f T du du c dT ou dU mc dT cvo vo vo dT (1) Da definição de entalpia: Portanto: h u pv u RT h f T dh dh c po dT ou dH mcpo dT c po dT (2) Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Note acima que qualquer que seja o caminho, a variação de energia interna e entalpia serão as mesmas. As linhas de temperatura constante são também linhas de u de h constantes Os calores específicos a volume constante e pressão constante são também apenas função da temperatura: f T cvo calor específicoa volume cte.a zero pressão c po e f T calor específicoa pressão cte.a zero pressão Da definição de entalpia e utilizando as eqs. 1 e 2: dh du RdT c po dT cvo dT RdT c po cvo R ou c po cvo R sempre constante Precisamos conhecer apenas um deles! Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Quando c po pode ser considerado constante? Se o calor específico c po é constante, integra-se diretamente a Eq. (2): h2 h1 c po T2 T1 uma média, por exemplo O valor médio deve ser avaliado no intervalo de temperatura de aplicação Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Entretanto, muitas vezes não podemos supor constante. c po Uma possibilidade são as equações ajustadas empiricamente: c po Co C1 C2 2 C3 3 onde: [kJ/Kg K] T Kelvin / 1000 Outra possibilidade é a integração dos cálculos da termodinâmica estatística: h2 h1 hT2 hT1 (+) (Sendo a função hT retirada das tabelas de gases perfeitos) Portanto, temos três possibilidades para avaliar c po : 1. Tabelas de gás ideal 2. Equações empíricas precisão (-) 3. Calor específico constante Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Processo Politrópico de Gás Ideal Para processo politrópico: ou p2 V1 p1 V2 pV n cte. n Para gás perfeito: T2 p2 T1 p1 e W 2 1 2 W 1 n 1 / n V1 V2 n 1 mR T2 T1 pd V 1 n n 1 V2 pd V mRT ln V1 n 1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Exemplo 1: Determine a mudança na entalpia específica, em kJ/kg, para vapor de água de um estado onde T1 = 400 K e p1 = 0,1 MPa para um estado onde T2 = 900 K e p1 = 0,5 MPa; (a) Use a tabela de vapor superaquecido (b) Integre uma expressão empírica adequada (c) Repita as partes (a) e (b) para uma pressão final de 60 MPa Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Exemplo 2 Dois tanques estão conectados por uma válvula. Um tanque contém 2 kg de monóxido de carbônico a 77 oC e 70 kPa. O outro tanque contém 8 kg do mesmo gás a 27 oC e 120 kPa. A válvula é aberta e os gases se misturam enquanto recebem energia por transferência de calor da vizinhança. A temperatura final de equilíbrio é 42oC. Utilizando o modelo de gás perfeito, determine: (a) A pressão final de equilíbrio, em kPa (b) O calor transferido no processo, em kJ. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Exemplo 3: Ar passa por um processo politrópico de compressão num conjunto pistão-cilindro de p1 = 100 kPa, T1 = 21 oC para p2 = 500 kPa. Empregando o modelo do gás ideal, determine (a) o trabalho e (b) o calor transferido por unidade de massa, em kJ/kg, se n = 1,3.
Baixar