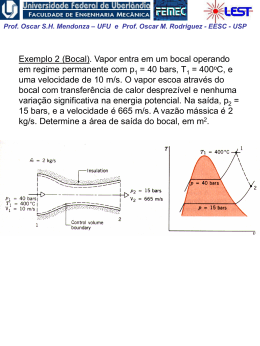
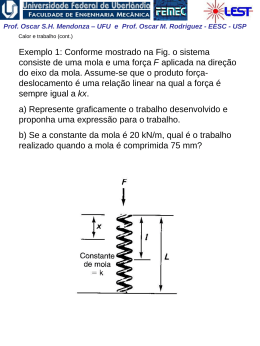
Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP 2. Conceitos e Definições Sistema e Volume de Controle • Sistema Termodinâmico: região do espaço delimitada fisicamente por superfícies geométricas arbitrárias reais ou imaginárias, que podem ser fixas ou móveis. Dentro dos seus limites, o sistema deverá estar cheio de matéria. • Arredores: tudo o que é externo ao sistema termodinâmico • Sistema fechado: composto por uma quantidade de matéria com massa e identidade fixas; apenas calor e trabalho podem cruzar a fronteira do sistema. • Sistema aberto (ou Volume de controle): massa, assim como calor e trabalho, pode atravessar a superfície de controle Peso (limite real do sistema) Pistão Fluído Substância a)- Limite do sistema b)- do sistema Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Ponto de Vista Macroscópico e Microscópico • Ponto de vista microscópico: termodinâmica estatística. Teoria cinética e mecânica estatística. Ex.: a pressão que um gás exerce nas paredes de um recipiente é resultante da mudança na quantidade de movimento da moléculas quando estas colidem com as paredes. • Ponto de vista macroscópico: termodinâmica clássica. Ex.: a pressão é a força média no tempo, exercida pelas moléculas, que atua sobre uma certa área e que pode ser medida com um manômetro. Obs.: tal observação macroscópica baseia-se na hipótese do contínuo. 2 dy y 2 y1 y 1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Estado e Propriedades de uma substância •Estado: é a posição energética em equilíbrio de um sistema definido por um número determinado de propriedades independentes. •Fase: em cada fase (líquida, sólida ou vapor), a substância pode existir a várias pressões e temperaturas ou, usando a terminologia termodinâmica, em vários estados. •Propriedade termodinâmica: qualquer grandeza que depende do estado do sistema e é independente do caminho; matematicamente: 2 dy y 2 y1 y 1 •Propriedade Intensiva: independente da massa; ex.: pressão, temperatura, concentração, massa específica, etc.; notação: letra minúscula (y) •Propriedade Extensiva: varia diretamente com a massa; as propriedades extensivas podem ser acumuladas, ou seja, são o resultado de uma soma de seus valores nas diferentes porções de um sistema quando ele está subdividido ex.: massa, volume total, comprimento, etc.; notação: letra maiúscula (Y) n Yextensiva Yi i 1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Equilíbrio termodinâmico: quando um sistema está em equilíbrio em relação a todas as possíveis mudanças de estado. O termo estado estará sempre fazendo referência a um estado de equilíbrio, ou seja, a uma igualdade de forças (equações mecânicas), ou a um sistema não reagente (equilíbrio químico) ou , ainda, a uma igualdade de temperatura (equilíbrio térmico). Alguns exemplos de equilíbrio: •Térmico/Mecânico: relacionado com temperatura e pressão; •Equilíbrio de fases: relacionado com a tendência de não se ter transferência de uma espécie química de uma fase para outra; •Equilíbrio químico: indica tendência de não ocorrer reação química. 1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Exemplo de sistema composto Um sistema esta subdividido em quatro partes como mostra a figura. Qual seria uma estimativa razoável do volume específico do sistema abaixo? 1 2 m1 m2 3 m3 4 m4 As propriedades extensivas podem ser usadas para determinar o estado geral do sistema,no caso de gases ideaisusamosas leis de mistura de gases ideais, para obter a equação de estado do sistema composto: P m R T Se retirarmos a separação entre os gases, a pressão resultante de mistura dos gases será a soma das pressões parciais,caso seja suposto que cada gás ocupa todo o volume a mesma temperatura da mistura? p p1 p2 p3 p4 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Processos e Ciclos • Processo: É o resultado de uma sucessão contínua de estados de equilíbrio de um sistema. Um processo é iniciado num estado de equilíbrio e termina em outro. Se as propriedades descrevem o estado de um sistema apenas quando ele está em equilíbrio, como podemos descrever os estados de um sistema durante um processo? • Processo quase-equilíbrio: é um processo ideal, onde o desvio do equilíbrio termodinâmico é infinitesimal. Processos de vaporização de água Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Lista de processos com suas respectivas propriedades que permanecem constantes: Propriedade Constante Nome do Processo Temperatura Isotérmico Pressão Isobárico Volume Isométrico Entropia Isoentrópico Entalpia Isoentálpico Ciclo termodinâmico: quando um sistema, em um dado estado inicial, passa por um certo número de mudanças de estado e finalmente retorna ao estado inicial; ex.: água circulando numa instalação termoelétrica Obs.: não confundir ciclo termodinâmico com ciclo mecânico v 1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Volume Específico e massa especifica ou Densidade A densidade, ( kg/m3 ), de uma substância é definida como a massa de uma substância por unidade de volume. É uma propriedade intensiva, sendo o inverso do volume específico, v. v 1 m3 kg A densidade de um sistema pode variar de ponto a ponto. Uma definição para densidade pode ser dada por: m lim v v ' v Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Pressão A pressão num ponto de um fluido em repouso é igual em todas as direções sendo definida como a componente normal da força específica por unidade de área: n F p Lim AA A Unidades: • SI, pascal, onde: 1 Pa = 1 N / m2 • Sistema Inglês, psi ou lbf / in2, onde: Obs.: 1 atm 1 bar 100 kPa e 1 atm 14,5 psi Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Igualdade de Temperatura Como definir temperatura? A porta de madeira da entrada da nossa casa deve estar à mesma temperatura de sua maçaneta de metal; entretanto, com o toque, a madeira parece estar mais quente e a maçaneta mais fria. Para a observação da igualdade de temperatura entre dois corpos postos em contato, inicialmente com temperaturas diferentes, podemos: • avaliar as resistências elétricas • medir o comprimento de um dos lados de cada bloco • ler as colunas de mercúrio dos termômetros Se após um determinado tempo os dois corpos não apresentarem alterações em qualquer propriedade mensurável, quando colocados em contato térmico, dizemos que os dois corpos possuem igualdade de temperatura Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP A Lei zero da Termodinâmica “Quando dois corpos estão em equilíbrio térmico com um terceiro, os três estão em equilíbrio térmico entre si.” • Esta lei não é deduzida de outras leis e constitui a base para a medição da temperatura. • Quando dois corpos estão em equilíbrio térmico, eles devem compartilhar uma propriedade que indique ou se relacione com este estado de equilíbrio. Esta propriedade é chamada de temperatura. • Sempre que um corpo tiver igualdade de temperatura com o termômetro, podemos dizer que o corpo apresenta a temperatura lida no termômetro. A A B C Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Escalas de Temperatura Normalmente as escalas usam como referência pontos fixos ou estados térmicos fixos como nas escalas definidas por Fahrenheit e Celsius; as temperaturas assim medidas são conhecidas como temperaturas empíricas (t) : Pontos Fixos Ponto de Oxigênio (temperatura de equilíbrio entre o oxigênio líquido e seu vapor) Valor Numérico -182,962 Ponto Triplo da Água (temperatura de equilíbrio entre gelo, água líquida e vapor) 0,01 Ponto de vapor (temperatura de equilíbrio entre água líquida e seu vapor) 100 Ponto do zinco (temperatura de equilíbrio entre o zinco líquido e sólido) 419,58 Ponto da prata (temperatura de equilíbrio entre a prata líquida e sólida) 961,93 Ponto do ouro (temperatura de equilíbrio entre o ouro líquido e sólido) 961,93 A escala é arbitrária. Desta forma uma vez um número fixado para um estado termométrico arbitrário (0º C ponto do gelo) e uma vez uma diferença de temperatura e designada entre dois pontos fixos de referência (Ex: 100º C para Tvapor – Tgelo), todo o resto de temperatura nas escalas de temperatura assim definidas podem ser determinadas. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Escalas mais utilizadas • SI, escala Celsius (oC) (Anders Celsius, 1701-1744) •Escala absoluta: escala Kelvin (K) (Lord Kelvin 18241907) K = oC + 273,15 • Sistema Inglês, escala Fahrenheit (oF) (Gabriel Fahrenheit, 1686-1736) •Escala absoluta: escala Rankine (R) R = oF + 459,67 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Métodos de Medidas de Temperatura A temperatura de um objeto ou de um fluido não pode ser medida diretamente. Normalmente, medidas de temperatura são feitas medindo-se a mudança de alguma propriedade física escolhida que mude proporcionalmente com a variação de temperatura. As propriedades físicas normalmente utilizadas são: 1. 2. 3. 4. 5. 6. Expansão térmica Efeitos termoelétricos Resistência elétrica Cores de superfície Radiação térmica Pontos de fusão, ebulição e congelamento. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Termômetros de expansão volumétrica: Ex.: termômetro de vidro utilizando mercúrio como substância termométrica. isolamento conduto Fossa termométrica Material Condutor de Calor termômetro de vidro instalado em fossa termométrica(dedo de luva). Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Termômetros de resistência: O princípio de operação do termômetro é a mudança de resistência elétrica com a variação de temperatura. a b a b c d Sensor c A B a b c d C arranjos diversos para termômetros de resistência Sensor Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Pirômetros Termométricos (Termopar): Efeito descoberto quando dois metais diferentes são unidos e aquecidos. A força eletromotriz (fem) originada dessas duas juntas, em duas diferentes fontes de calor é chamada de Peltier e de efeito Thomson. É desejável que o termopar produza uma fem grande na sua faixa de operação e que a relação fem versus temperatura seja linear. Cromo 40 30 f.e.m[milivolts] 20 10 Cobre Ferro 0 10 Alumel 20 30 40 Constantan Temperatura[°C] Força eletromotriz gerada para diferentes termopares, relativas ao termopar de platina Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Termopar (cont.). Aplicação no laboratório
Baixar