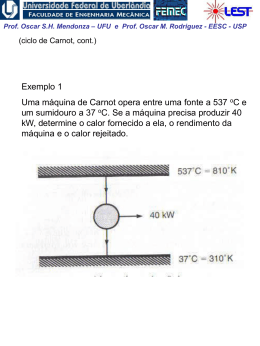
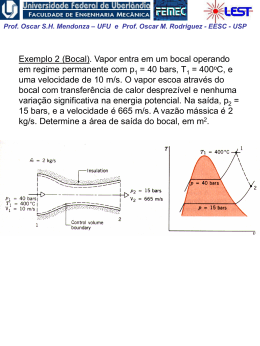
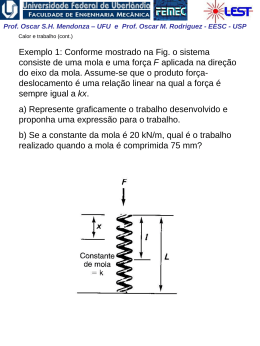
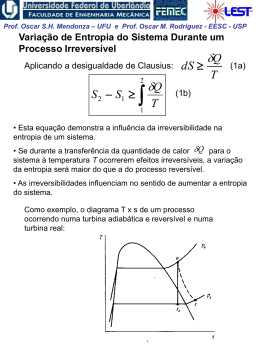
Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Entropia (Análise da segunda lei para processos) 1a lei para processos: definição da propriedade energia interna, u. 2a lei para processos: definição da propriedade entropia, s. “A entropia está para a 2a lei assim como a entalpia está para a 1a lei” Desigualdade de Clausius A desigualdade de Clausius é uma conseqüência da 2a lei da termodinâmica Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Considere o ciclo reversível (Carnot) de um motor térmico Para um ciclo reversível: Q QH QL 0 , Se: TH Q T QH QL 0 TH TL TL , então : Q 0 , e : Q T 0 Portanto: Q 0 e Q T 0 (Para todo ciclo reversível de um motor térmico) Obs.: note que para o ciclo de Carnot a transferência de calor ocorre apenas no processo isotérmico, ou seja: Q 1 Q Q T T T Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Comparando um ciclo irreversível com um reversível (TH, TL e QH = ctes.) Wirrev Wrev QH QL (irrev ) QH QL ( rev ) QL (irrev ) QL ( rev ) Conseqüentemente: Q Q H QL (irrev ) 0 e No limite da irreversibilidade: Q QH QL (irrev ) 0 T TH TL Q Q 0 e T 0 Portanto: Q 0 e Q T 0 (Para todo ciclo irreversível de um motor térmico) Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Considere o ciclo de refrigeração (desenvolvimento similar ao realizado para motor térmico) Q Q 0 e T 0 Q Irreversível : Q 0 e 0 T Reversível: Portanto, para todos os ciclos: Desigualdade de Clausius Q T 0 (igualdade válida para ciclos reversíveis e desigualdade para ciclos irreversíveis) “Se um ciclo satisfaz a desigualdade de Clausius é equivalente dizer que a segunda lei da termidinâmica não foi violada.” Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Entropia, uma propriedade termodinâmica de um sistema A demonstração da existência da propriedade termodinâmica entropia pode ser feita de maneira semelhante à dedução da energia do sistema (Cap. 5). Prova-se que Q T é constante e independente do caminho para todos os caminhos reversíveis possíveis entre dois estados 1 e 2. A propriedade termodinâmica entropia pode ser definida por: Q dS T rev integrando: S2 S1 2 1 Q T rev (1) Obs.: Como entropia é uma propriedade, a mudança na entropia de uma substância indo de um estado a outro é a mesma para todos os processos, ambos reversíveis ou irreversíveis, entre esses dois estados; portanto, o resultado da Eq. (1), válida apenas para processo reversível, pode ser utilizado para avaliar a magnitude da mudança de entropia para todos os processos entre esses dois estados. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP A entropia para uma substância pura Assim como para qualquer propriedade termodinâmica, na região de saturação a entropia pode ser calculada utilizando-se o título: s (1 x) sl xsv s sl xslv Diagrama esquemático temperatura-entropia: Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Diagrama temperatura-entropia:
Baixar