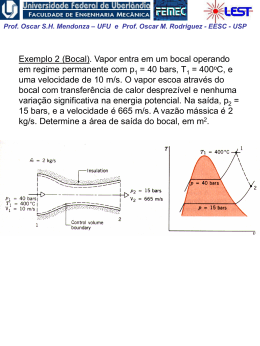
Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP CASO PARTICULARES 1- O processo em regime permanente (cont.): 1.1. Transferência de Calor e Trabalho em Processos Internamente Reversíveis em Regime Permanente Para processos em regime permanente: q dh dEC dEP w (1) mas h u pv (2) Assim: q du pdv vdp dEC dEP w (3) Da relação de Gibbs, temos que: Tds du pdv (4) a qual só contém funções de estado, sendo válida para quaisquer dois estados de equilíbrio, para processos sem escoamento ou com escoamento permanente, reversível ou irreversível. Porém, Tds q e pdv w apenas para processos internamente reversíveis. Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Portanto, podemos integrar a Eq. (4) por intermédio de qualquer processo reversível que passe pelos pontos inicial e final, mas as interações com a vizinhança ao longo desse processo reversível não serão idênticas às interações no processo real. Fazendo: q Tds (para proc. reversível) na Eq. (3): Tds du pdv vdp dEC dEP w (5) Substituindo a Eq. (4) na Eq. (5), temos que: vdp dEC dEP w (6) Quando ΔEC e ΔEP são desprezíveis, temos que: vdp w ou 2 w vdp (7) 1 Que nos diz que num processo reversível em regime permanente a integral vdp é igual ao trabalho de eixo w. Se o processo for irreversível, significado expresso pela Eq. (7). vdp não tem o Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Agora, diferenciando a Eq. (2) e usando a Eq. (4), encontramos que: dh du pdv vdp , e então : dh Tds vdp ou : vdp Tds dh (8) Substituindo a Eq. (8) na Eq. (7), temos que: 2 w Tds dh 1 Quando o processo é reversível: Tds q , e se q 0 (proc.adiabático) : 2 w dh 1 (9) Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP A integral vdp representa uma área sobre o plano pv , conforme na Fig., que é a área subtendida pela curva. A área 1-2-a-b representa o trabalho num processo reversível em regime permanente, quando ΔEC = ΔEP = 0. No caso de q = 0 ela representa também –Δh. w vdp é positivo de 1 para 2 (expansão) Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP 1.2. Para processo politrópico, temos que: pvn cte. (10) Da análise realizada para processos em regime permanente, obtemos através da substituição da Eq. (10) na Eq. (7) e integrando (ΔEC e ΔEP = 0): 2 2 w vdp cte. 1n 1 1 dp 1n p n p2 v2 p1v1 (11) n 1 (politrópico, n 1) Para n = 1, pv = cte. e o trabalho é dado então por: 2 2 dp w vdp cte. p 1 1 p2 p1v1 ln (12) p1 (politrópico, n = 1) Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP As Eqs. (11) e (12) aplicam-se de forma geral para processos politrópicos de qualquer gás ou líquido. Para o caso especial de um gás perfeito, a Eq. (11) podem ser representada por: nR w (T2 T1 ) (13) n 1 (gás ideal, n 1) E a Eq. (12): p2 w RT ln (14) p1 (gás ideal, n = 1) d ms vc m2 s2 m1s1 vc 0 dt t Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP CASO PARTICULARES 2- O processo em regime transitório: a 2ª Lei integrada com as limitações deste processo, pode ser escrita como: Qvc d A dA ms vc ms ss m e se dt T sc Integrando no intervalo de tempo “t”, teremos: d 0 dt ms vc m2 s2 m1s1 vc t m s t 0 s s dt ms ss m s dt m s t 0 e e e e Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Portanto para o intervalo de tempo considerado, a segunda lei para fluxo uniforme poderá ser escrita: Qvc t A dAdt m2 s2 m1s1 vc ms ss m e se 0 T sc Porém como neste processo a temperatura dentro do vc, é uniforme através de todo o vc, a integral do lado direito da equação ficará: Qvc t A dA dt t Qvc dA dt t Qvc dt 0 sc T 0 sc T 0 T Assim a forma final da equação fica: Qvc m2 s2 m1s1 vc ms ss m e se 0 dt T t Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Os termos da equação podem melhor ser explicitados: mudança de entropia dentro do m2 s2 m1s1 vc =volume de controle. ms ss m ese Qvc 0 T dt t = mudança de entropia devida aos fluxos de massa = mudança de entropia devida à transferência de calor Para apenas uma entrada e uma saída e uma área de transferência de calor: m2 s2 m1s1 vc ms ss me se 1 Q2, vc T ou: m2 s2 m1s1 vc ms ss me se 1 Q2, vc T 1 S 2, ger Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Exemplo 1. Vapor de água a 6,8 bar e 260 ºC, escoa por um duto distribuidor, ligado ao duto, um recipiente de 1,4158 m3, contendo vapor de água inicialmente a 1 bar e 176 ºC. Abrimos o registro de ligação duto-recipiente, lentamente, para permitir a entrada de vapor ao recipiente, até que a pressão no recipiente seja igual a 6,8 bar. Durante o processo de transferência de vapor, a temperatura do vapor no recipiente se mantém, constante (176 ºC). Se os arredores (ambiente) do recipiente estão a 26,6 ºC. a) Encontrar a massa de vapor que entra no recipiente e o calor transmitido entre recipiente –ambiente durante o processo. b) Encontrar a mudança de entropia ocorrida no recipiente durante o processo. c) Demonstre que este processo não viola a 2ª Lei da Termodinâmica.
Baixar