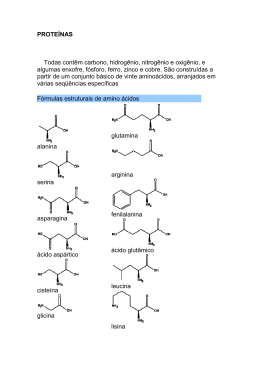
Estrutura e função • Petídeos e proteínas são formados a partir da polimerização de aminoácidos • A reação de polimerização é uma reação de condensação, ocorre com perda de uma molécula de água formando a ligação peptídica. Formação da ligação peptídica Muitos hormônios possuem estrutura peptídica ou protéica. A insulina, hormônio importante no controle dos níveis de açúcar no sangue é uma proteína com 51 aminoácidos. Várias enzimas que participam no processo digestivo, também são proteínas. Proteínas dão sustentação aos dentes (colágeno) e protegem o organismo (anticorpos). Biomoléculas grandes (polímeros) formadas por vários aminoácidos ligados através da ligação peptídica. Polímeros com até 50 aminoácidos são chamados peptídeos. Polímeros com mais de 50 aminoácidos são classificados como proteínas. 1- estrutura primária – corresponde à seqüência de aminoácidos. 2- estrutura secundária – forma em espiral (alfa-hélice) ou folha beta pregueada – ambas estabilizadas por pontes de hidrogênio entre a carbonila de uma ligação e o hidrogênio do grupo imido (NH) da 3ª ligação seguinte. 3- estrutura terciária – dobramento da cadeia polipeptídica sobre si mesma, se enovelando e formando uma estrutura mais compacta. Contribuem: interações eletrostáticas, pontes de hidrogênio, interações hidrofóbicas, pontes de dissulfeto. 4- estrutura quaternária – apresentada apenas por algunas proteínas, constitui o grau de polimerização de unidades protéicas, formando dímeros, trímeros, tretâmeros. Estabilizada pelas mesmas forças da estrutura terciária. Em alguns casos, há contribuição de cátions metálicos. A cadeia polipeptídica de um oligopeptídeo e de proteínas assume uma estrutura tridimensional a partir de arranjos regulares de aminoácidos próximos uns aos outros na seqüência. Alfa-hélice e folha beta são exemplos de estruturas secundárias normalmente encontradas em proteínas. Tais estruturas são estabilizadas por várias pontes de hidrogênio. Estabilização por pontes de hidrogênio Ligação por ponte de hidrogênio Alfa-hélice Folha beta pregueada A estrutura primária de uma cadeia polipeptídica determina sua estrutura terciária. Por exemplo, proteínas globulares em solução aquosa são compactas, com uma alta densidade de átomos no centro da molécula protéica. Cadeias laterais hidrofóbicas estão normalmente localizadas no interior da molécula, enquanto grupamentos polares (hidrofílicos) são geralmente encontrados na superfície da proteína. Diversas interações podem contribuir para formar a estrutura terciária: 1) Interação hidrofóbica 2) Pontes de hidrogênio 3) Interações eletrostáticas 4) Pontes de dissulfeto Muitas proteínas consistem em uma única cadeia polipeptídica (proteínas monoméricas). Algumas, porém, consistem em duas ou mais cadeias polipeptídicas que podem ser estruturalmente idênticas ou totalmente diferentes. O arranjo destas subunidades polipeptídicas é denominado estrutura quaternária da proteína. Podem gerar estruturas diméricas, triméricas ou multiméricas. A estrutura da hemoglobina apresentada acima é composta de quatro moléculas protéicas. Duas subunidades alfa e duas subunidades beta. As quatro moléculas são unidas por interações hidrofóbicas, o que mantém esta proteína ativa através da estrutura quaternária. A estrutura do cabelo. A unidade estrutural básica é uma cadeia polipeptídica de alfa-queratina. O cabelo pode ser esticado até duas vezes seu comprimento. A forma beta da queratina, encontrada na seda e teias de aranha, contém estrutura em folha beta. É flexível mas não se estica. Desnaturação é um processo associado à perda da estrutura tridimensional nativa de uma proteína. Resulta no desdobramento e desorganização da estrutura. Agentes que podem causar a desnaturação são: 1) Temperatura 2) Variações de pH (pela adição de ácidos ou bases fortes) 3) Variações na polaridade do solvente (adição de solventes apolares) 4) Detergentes, sais (aumento da força iônica), metais pesados (Hg, Pb), uréia. 5) Agitação mecânica Pode ser promovida por enzimas (proteases) ou por tratamento com ácido clorídrico 6 mol/L a 120ºC durante 12 horas. Consiste no rompimento das ligações peptídicas. Através da hidrólise, há liberação dos aminoácidos que podem ser utilizados novamente na síntese protéica. A digestão de proteínas envolve a hidrólise enzimática. No estômago, por exemplo, as proteínas ingeridas no bolo alimentar são desnaturadas devido ao pH do meio e hidrolisadas pela ação de enzimas como a pepsina. A hidrólise de proteínas ingeridas na alimentação é importante para que se obtenham os aminoácidos essenciais: fenilalanina, histidina, isoleucina, leucina, lisina, metionina, treonina, triptofano e valina - os quais nosso organismo não consegue sintetizar - mas precisa para a síntese de novas proteínas. Enzimas: aceleram as reações. Transporte: Hemoglobina, lipoproteínas Nutrição: ovoalbumina, caseina, ferritina Contração: actina, miosina Estrutural: colágeno, elastina, queratina Defesa: imunoglobulinas (anticorpos) Regulação: hormônios e repressores Composição: proteínas simples e conjugadas Conformação: proteínas globulares e fibrosas Proteínas simples: formadas apenas de aminoácidos (albuminas e globulinas). Conjugadas: apresentam uma porção não-protéica Proteína conjugada Grupo prostético glicoproteína carboidrato lipoproteína lipídio nucleoproteína Ácido nucléico metaloproteína metal Globulares: aquelas cuja cadeia polipeptídica se dobrou consideravelmente, assumindo a forma esférica ou globular. Fibrosas: podem ser divididas em 3 classes: 1. Alfa hélice de passo direito (queratina da pele, cabelo e unhas) 2. Folha beta-pregueada (seda) 3. Hélice tripla (colágeno) Tais proteínas são insolúveis, característica necessária para suas funções biológicas.
Baixar