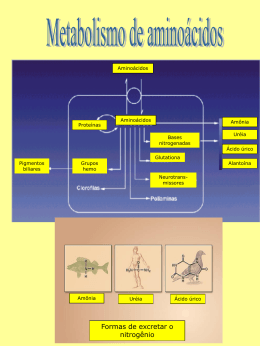
Metabolismo das Proteínas Curso de Especialização Nutrição Enteral e Parenteral PUCRS Profas. Ana Maria Feoli e Sônia Alscher Proteínas Macromoléculas resultantes da condensação de moléculas de -aminoácidos através de ligação peptídica. COOH N- C - H 3 R Aminoácidos • Unidades fundamentais das proteínas • Apresentam pelo menos um grupo carboxílico e um grupo amino • Aminoácidos geral: têm como COO H N - C - H 3 R fórmula Alanina COO H - C - CH3 NH3 + Ligações Peptídicas Estrutura das Proteínas Aminoácidos Dipeptídios Polipetídios Ligações peptídicas são mais estáveis – hidrólise requer condições extremas. No organismo, ligações peptídicas são clivadas por enzimas como proteases ou peptidases. Desnaturação Protéica Estrutura = Função Alteração extrema da estrutura tridimensional e perda da função • Calor; • pH extremo; • Detergentes. Hemoglobina Proteínas Funções: • Crescimento e manutenção; • Enzimas; • Hormônios; • Anticorpos; • Energia; • Componentes estruturais. Classificação das proteínas de acordo com sua função biológica Classe Enzimas Exemplo Tripsina, Lipase, Amilase Proteínas Transportadoras Hemoglobina, lipoproteínas Proteínas contráteis ou de movimento Actina, Miosina Proteínas estruturais Queratina, Colágeno, Elastina Proteínas de defesa Anticorpos, toxina botulínica Hormônios Insulina, Hormônio do crescimento Proteínas nutritivas ou de reservas Albumina (ovo) Caseína (leite) DESTINO DOS AA APÓS A DIGESTÃO • Síntese de proteínas; • Síntese de peptídios menores (glutationa); • Substâncias nitrogenadas (heme, neurotransmissores, hormônios); • Energia (somente em momentos de catabolismo). Além disso.... IMPORTANTE: Excesso de Proteína Triglicerídios Glicogênio Caso não ocorra aumento das necessidades protéicas. Aminoácidos Essenciais Não biossintetizados no organismo Devem ser ingeridos com dieta CH3 - CH - CH - COOH CH3 NH2 Valina CH3 - CH - CH2 - CH - COOH CH3 Leucina NH2 Essenciais Fenilalanina Triptofano Valina Leucina Isoleucina Metionina Treonina Lisina Dieta Condicionalmente Essenciais Glicina Prolina Tirosina Serina Cisteína e Cistina Taurina Arginina Histidina Glutamina Não essenciais Alanina Ácidos Aspártico Ácido Glutâmico Asparagina Certas condições clínicas Taurina Cisteína – Crianças prematuras Sintetizados no organismo Proteínas do alimento: Qualidade, Consumo e Necessidade • Qualidade – depende do conteúdo de aminoácidos; • Aminoácido essencial e não essencial; • Proteína completa; • Aminoácido limitante - Aquele que falta (não disponível por dieta ou catabolismo intenso) na estrutura da proteína a ser construída. Necessidades Nutricionais de Proteínas • 10 –15% de proteínas/dia RELAÇÃO KCAL/g DE N • Normal e s/ estresse: 200-300:1 • Estresse moderado: 150:1 • Estresse severo: 100:1 • Reflete a proporção entre kcal e ptn a fim de que esta seja utilizada apenas para fins de construção tecidual, sem desperdício de aa em gliconeogênese 6,25g de ptn = 1 g de nitrogênio Cálculo • Cal: N relação de 150:1 • Requisito calórico total/ 150= g N • g de nitrogênio X 6,25 = g ptn Qualidade das proteínas Albumina = 100% Proteína Padrão PAVB Contém todos os aa essenciais PBVB Deficiência de um ou mais aa essenciais • Arroz Rico em metionina Pobre em lisina Aa limitante • Feijão Rico em lisina Pobre em metionina Aa limitante EQUILÍBRIO DINÂMICO DAS PROTEÍNAS • EXCESSO AA: não é armazenado nem excretado: transforma-se em precursores do CK - piruvato, oxaloacetato, acetoglutarato produção de energia Proteínas Corporais • “Pool” de aminoácidos - Aas liberados das proteínas da dieta; +/- 100 g de aa/dia; • Exemplo: Homem 70 kg (12 kg ptn) pool pequeno! Turnover de Proteína – Proteínas corporais estão constantemente sendo sintetizadas e degradadas. 300-400 g ptn corporal/dia Velocidade do Turnover • Varia entre as proteínas • Exemplo: proteínas digestivas (minutos) x colágeno (dias) MEIA-VIDA • Grupo A: Ptns rapidamente sintetizadas, vida finita e rapidamente degradadas. Albumina (20 dias), Hemoglobina (120 dias) • Grupo B: Rapidamente sintetizadas e degradadas. Enzimas que regulam as vias metabólicas. • Grupo C: tem meia vida longa. Colágeno Balanço Nitrogenado Nitrogênio Consumido = Nitrogênio Excretado • Balanço Nitrogenado POSITIVO: Ingestão MAIOR excreção Exemplos: crianças, gestantes, recuperação de doenças. • Balanço Nitrogenado NEGATIVO: Ingestão MENOR excreção Exemplos: Estresse fisiológico (trauma, sepse, queimaduras. Metabolismo dos Aas depende: Suprimento de nutrientes: •Jejum noturno; •Dieta balanceada; •Dieta hiperproteica. Demanda de Aas: •Estresse cirúrgico; •Sepse; •Trauma; •Queimaduras. Resposta Hormonal x Dieta: •Insulina •Glucagon Estresse Fisiológico •Glicocorticóides •Epinefrina Estado Alimentado Metabolismo dos Aminoácidos no Estado Alimentado Gliconeogênese Jejum Glucagon CICLO GLICOSE-ALANINA • Alanina exportada do músculo ao fígado • Transaminação: alanina fígado: gliconeogênese piruvato, no Aminoácidos Cetogênicos Aas que produzem Acetil CoA ou corpos cetônicos Aminoácidos Glicogênicos TRANSAMINAÇÃO • Possibilita a desaminação, separando o grupo amino (NH3) do esqueleto carbonado (intermediários metabólicos); • Transferência do seu grupo amino para o respectivo alfa-cetoácido; • Geralmente: aceptor é alfacetoglutarato, convertido a glutamato; • PIRIDOXAL (vit B6): co-fator. Reação de Transaminação Transaminação: Principal processo de remoção do nitrogênio dos aas. TRANSAMINAÇÃO • Outros aceptores de NH3: oxaloacetato, formando aspartato • No músculo: piruvato, formando alanina • AMINOTRANFERASES: TGO TGP Ciclo da Uréia Adulto Normal Balanço Nitrogenado Principal Composto Excretor de Nitrogênio – Uréia Uréia – Produzida no fígado Excretada pelo rim (urina) CICLO DA URÉIA • Formada no fígado; • Conduzida por glutamina ao rim; • Excretada no rim; • Catabolismo: esgotamento da reservas de alfa-cetoglutarato e glutamato. Ciclo da uréia Regulação do Ciclo da Uréia Fígado tem alta capacidade de converter Nitrogênio dos aas em uréia (prevenção efeitos tóxicos da amônia) Ciclo da uréia regulado pela disponibilidade de substrato. + Aas ----------------- + Ciclo da uréia A indução do ciclo da uréia ocorre em resposta a condições que requerem um aumento do metabolismo das proteínas. Dieta hiperprotéica Jejum prolongado Tópicos Especiais Aminoácidos de Cadeia Ramificada (AACR) • Leucina, isoleucina e valina • Utilizados pelas células musculares • Cetogênicos - dão em Acetil-coA Aminoácidos de Cadeia Ramificada (AACR) • Aumento da taxa de síntese protéica no músculo • Encefalopatia hepática: competição pelos sítios de absorção com os aa aromáticos (tirosina, fenilalanina e triptofano) GLUTAMINA • Condicionalmente essencial no estresse; • Mais de 60% do pool de aa livres no músculo; • 20% do pool sangüíneo de aa; • Durante patologias, exportada pelo músculo intensamente. GLUTAMINA • Gliconeogênese • Substrato energético dos enterócitos e sistema imunológico; • “Escoamento” e falta de glutamina em condição de estresse. ARGININA • Metabólito intermediário no ciclo da uréia; • Produção de NO; • Imunoestimulantes; • Cicatrização de feridas. CISTEÍNA - aa condicionalmente essencial • Precursora da glutationa (GSH) • GSH - Tripeptídeo: cisteína, glutamato, glicina • Antioxidante central do corpo • Ptn do soro do leite (lactalbumina) é fonte rica em cisteína (2,3%), comparada com caseína (0,3%)
Baixar