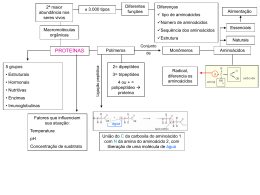
Aula: 18 Temática: Estrutura dos aminoácidos e proteínas – parte III A maioria das cadeias polipeptídicas naturais contém entre 50 e 2.000 aminoácidos e são comumente referidas como proteínas. Peptídeos constituídos de números pequenos de aminoácidos são chamados de oligopeptídeos, ou simplesmente peptídeos. As proteínas são polímeros lineares formados pela união de uma carboxila α de um aminoácido à amina α de outro por uma ligação peptídica. Existem muitos peptídeos biologicamente naturais que são importantes, como os hormônios peptídicos de mamíferos, fatores de crescimento e produtos bacterianos. Todos esses, com exceção dos peptídeos menores, são designados polipeptídeos. À medida que o número de aminoácidos aumenta, atinge-se um ponto em que a prática sugere o uso do termo proteína em vez de polipeptídeo. Polipeptídios De Importância Biológica Em algumas proteínas, a cadeia peptídica linear é interligada. As mais comuns das interligações são as pontes dissulfeto, formadas cada uma pela oxidação de um par de radicais de cisteína. A unidade resultante de cisteínas ligadas é BIOQUÍMICA chamada de cistina (fig. 1). Proteínas extracelulares freqüentemente possuem várias pontes dissulfeto, enquanto as intracelulares geralmente não as contêm. Fig. 1 – Pontes de dissulfeto. Todas as proteínas, apesar da variabilidade que apresentam, possuem o traço comum de conterem resíduos de aminoácidos unidos por ligações peptídicas. Cada proteína adquire propriedades características devido a: 1) Seqüência dos aminoácidos na cadeia; 2) Ligações entre os grupos R dos aminoácidos; 3) Presença de certos átomos e moléculas ou unidades que não são aminoácidos, denominados grupos prostéticos (p. ex., Fe3+ , Co2+). Existem quatro níveis de organização estrutural nas moléculas protéicas. A estrutura primária é estabelecida pela seqüência dos vários resíduos de aminoácidos unidos por ligação peptidíca. A estrutura secundária é dada pelo enovelamento desta cadeia, em formas características - geralmente em hélices. Quando estas hélices se dobram ou se enovelam sobre si mesmas, temos a estrutura terciária. Finalmente, a estrutura quaternária é dada pelo BIOQUÍMICA arranjo ou união de várias subunidades de polipeptídeos ou proteínas, formando uma superestrutura protéica (Fig. 2). Fig. 2 - Níveis de organização das ligações peptídicas nas proteínas: (A) primária; (B) secundária (helicoidal); (C) terciária, mostrando o enovelamento da cadeia; (D) quaternário, mostrando a agregação das cadeias α e β. Estrutura Primária: Os aminoácidos se unem por ligações peptídicas formando cadeias peptídicas. Os aminoácidos em um peptídeo são unidos por ligações amida formadas entre a carboxila de um aminoácido e a amina do seguinte. Esta união, chamada de ligação peptídica, tem diversas propriedades importantes. Primeiro, é resistente a hidrólise e assim as proteínas têm cinéticas notavelmente estáveis. Segundo, o grupamento peptídico é plano, porque a ligação C—N tem um considerável caráter de dupla ligação. Terceiro, cada ligação peptídica tem tanto um doador de ponte de hidrogênio (o grupamento NH) quanto um aceptor (o grupamento CO). As pontes de hidrogênio entre estes grupamentos da cadeia principal são uma característica distintiva da estrutura das proteínas. Finalmente, a ligação peptídica não tem carga elétrica, o que permite que as proteínas formem estruturas globulares firmemente acomodadas, com quantidades significativas do arcabouço imersas no interior da proteína. Como são polímeros lineares, as proteínas podem ser descritas como seqüências de aminoácidos. BIOQUÍMICA Estrutura Secundária: As cadeias peptídicas podem se dobrar em estruturas regulares. A estrutura secundária das proteínas tem dois aspectos. O primeiro consiste no modo segundo o qual a cadeia protéica é enrolada e dobrada; o segundo se refere à natureza das ligações que estabilizam esta estrutura. O componente principal na estrutura secundária das proteínas é a hélice α. Podemos visualizar a forma desta hélice imaginando o que aconteceria se a cadeia peptídica fosse enrolada ao longo de um bastão. A estabilidade da hélice depende de pontes de hidrogênio. Na α hélice, a cadeia peptídica se retorce, formando um bastão firmemente acomodado. Dentro da hélice o grupamento CO de cada aminoácido forma pontes de hidrogênio com o NH a quatro monômeros adiante na cadeia peptídica e na volta seguinte da espiral. Estas pontes de hidrogênio estabilizam a estrutura helicoidal das proteínas. A hélice α é uma estrutura geral compatível com a presença de qualquer cadeia lateral no resíduo de aminoácido. Estrutura Terciária: Proteínas hidrossolúveis se enovelam em estruturas compactas com o interior apolar: A pesar da estabilização decorrente das pontes internas de hidrogênio, a estrutura da hélice α não é suficientemente estável em soluções aquosas, podendo desenrolar-se e dar origem a uma fita que é dobrada ou enovelada ao acaso. A estabilização do enovelamento helicoidal e dobramento da hélice, que resulta na estrutura terciária das proteínas, exige outros tipos de ligação além das pontes de hidrogênio. Tais ligações são formadas entre as cadeias laterais ou grupos R dos aminoácidos da cadeia peptídica. Essas ligações podem ser iônicas, não-polares (hidrofóbicas), covalentes, pontes de hidrogênio e ligações tipo Van der Waals. Para haver formação de pontes de hidrogênio entre os aminoácidos é necessário que um deles possua um grupo doador de hidrogênio, tal como a hidroxila (OH) na tirosina, e que o outro possua um grupo que aceite hidrogênio, como a carboxila (COOH) no BIOQUÍMICA ácido glutâmico. As ligações iônicas que existem no interior de uma proteína são formadas entre as cadeias laterais de aminoácidos capazes de ionizar-se e dar origem a grupos eletricamente carregados. Grupos que diferem quanto á carga, tal como o COO- do ácido glutâmico e o NH3+ da lisina, atraem-se mutuamente. Por outro lado haverá repulsão entre grupos cuja carga tem o mesmo sinal. Parece que as ligações não polares entre as cadeias laterais dos aminoácidos (Leu, Fen, Val, etc.) são baseadas no fato dos hidrocarbonetos serem insolúveis em água. Assim sendo, admite-se que há uma tendência para a cadeia peptídica enovelar-se. As estruturas terciárias de proteínas hidrossolúveis têm características em comum: 1) Um interior formado de aminoácidos com cadeias laterais hidrófobas; 2) Uma superfície formada em grande parte de aminoácidos hidrófilos que interagem com o meio aquoso. A força que impulsiona a formação da estrutura terciária de proteínas hidrossolúveis é a interação hidrófoba entre os aminoácidos no interior. Algumas proteínas que existem em um ambiente hidrófobo, em membranas, apresentam a distribuição inversa de aminoácidos. Nestas proteínas, os aminoácidos hidrófobos estão na superfície, para interagir com o meio, enquanto os grupamentos hidrófilos são protegidos do ambiente no interior da proteína. Estrutura Quaternária: Cadeias peptídicas podem se associar em estruturas com múltiplas subunidades: Proteínas constituídas de mais de uma cadeia peptídica apresentam estrutura quaternária, e cada cadeia peptídica individual é chamada de uma subunidade. A estrutura quaternária pode ser tão simples quanto duas subunidades diferentes. Na maioria dos casos, as subunidades são mantidas juntas por interações não covalentes. A forma das proteínas é um fator muito importante em sua atividade, pois se ela é alterada, a proteína torna-se inativa. Esse processo de alteração da forma da proteína é denominado desnaturação, podendo ser provocado por altas BIOQUÍMICA temperaturas, alterações de pH e outros fatores. A desnaturação consiste na quebra das estruturas secundária e terciária de uma proteína (fig. 3). Fig. 3 - Molécula protéica globosa, em sua configuração nativa e a mesma molécula em estado desnaturado. Proteínas diferem muito quanto à forma, tamanho e peso molecular. A menor proteína conhecida tem peso molecular 6.000 vezes maior que o peso de um átomo de hidrogênio, isto é, seu peso molecular é cerca de 6.000. As maiores proteínas conhecidas têm peso molecular da ordem de 7.000.000. As proteínas, ainda podem ser classificadas como: 1) Proteínas simples ou homoproteínas: constituídas exclusivamente por aminoácidos. Temos como exemplo: - Albuminas: São as menores proteínas (com menor peso molecular). Encontram-se nos animais e vegetais. São solúveis na água. Exemplos: albumina do plasma sangüíneo e da clara do ovo. - Globulinas: Possuem um peso molecular um pouco mais elevado. Ocorrem em animais e vegetais. São solúveis em água salgada. Exemplos: anticorpos e fibrinogênio. - Escleroproteínas ou proteínas fibrosas: Seu peso molecular é muito elevado. São exclusivas dos animais, sendo insolúveis na maioria dos solventes orgânicos. Exemplos: colágeno, elastina e queratina. BIOQUÍMICA 2) Proteínas Conjugadas ou heteroproteínas: Muitas vezes, nos organismos, as proteínas acham-se associadas a metabólitos bioquímicos. Quando uma proteína está associada a um grupo prostético, é denominada proteína conjugada ou heteroproteína. São proteínas deste tipo a hemoglobina e a mioglobina que são metaloproteinas (contendo metais). As lipoproteínas (contendo lipídeos) e as glicoproteínas (contendo carboidratos) são componentes estruturais importantes de membranas celulares e de partículas celulares. As nucleoproteínas, que contêm ácidos nucléicos, são partes integrantes do aparelho genético dos organismos. Exemplos de proteínas conjugadas estão na tabela abaixo. 3) Proteínas Derivadas: formam-se a partir de outras por desnaturação ou hidrólise, como por exemplo as proteoses e as peptonas, formadas durante a digestão. Na próxima aula estudaremos as funções das proteínas. Até lá! BIOQUÍMICA
Download