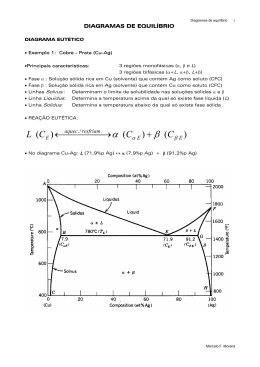
Diagrama de fases São diagramas que mostram regiões de estabilidade das fases, através de gráficos que representam as relações entre temperatura, pressão e composição química. Para que serve: Investigar reações Químicas; Entender a microestrutura dos materiais; Prever as suas propriedades; Etc. Sistema Série de possíveis ligas com mesmos componentes, mas composições e microestruturas distintas Ex: Sistema Cobre-Oxigênio A variação da composição de oxigênio leva a diferentes estruturas microscópicas, bem como a formação de diferentes fases Solução sólida Fase homogênea que contem 2 ou mais componentes (solutos) dissolvidos em um solvente. Ex: Latão Liga com até 30% de Zinco em Cobre Fase Uma porção de um sistema que possui propriedades e composição homogêneas e que é fisicamente distinta das outras partes do sistema. Cr+ 3% Nb – Região de contorno de grão Equilíbrio termodinâmico Um sistema está em equilíbrio se a sua energia livre (G) se encontra em um valor mínimo para alguma combinação específica de temperatura, pressão e composição Energia Livre de Gibbs Energia Livre de Gibbs A Energia Livre de Gibbs é uma medida de estabilidade de um sistema de fases. Quando a variação dessa energia é nula, diz-se que o sistema está em equilíbrio ou está estável. Energia Livre de Gibbs ( G ) ∆G = ∆H – T∆S Onde: H = entalpia do sistema; T = temperatura; S = entropia do sistema. Entalpia (H) Entalpia é o conteúdo de calor de um sistema, à pressão constante de fórmula: H = E + PV Onde: E =energia interna do sistema; P =pressão; V =volume. Entropia (S) É a medida de desordem de um sistema. Quanto maior a desorganização do sistema, maior a entropia. Onde: dQ dS T Q=Quantidade de calor; T= temperatura. Fonte: Porter e Easterling Fonte: Porter and Easterling Fonte: Porter and Easterling Fonte: Porter e Easterling Limite de solubilidade A uma dada temperatura existe uma concentração máxima de soluto que pode se dissolver no solvente. Esse limite chama-se limite de solubilidade Água e açúcar Solubilidade Total Efeito da Pressão Superliga de Niquel Microestrutura Nimonic (Ni+Co) – 400X Ti 6Al-4V – 400X A microestrutura pode ser observada por microscópio ótico ou eletrônico. Podem ser identificadas as fases e a quantidade delas no material. Cada fase possui propriedades diferentes. Aço Comum Baixo Carbono Al+4% Cu Cu+Sn – Estrutura Dentrítica Cu+Zn - Latão Microestrutura de um aço O Aço possui diversas microestruturas devido ao seu diagrama de fases e aos diferentes metodos de processamento Austenita Resfriamento lento Perlita ( + Fe3C) + Fase próeutetóide Resfriamento moderado Bainita ( + Fe3C) Resfriamento rápido (têmpera) Martensita (fase tetragonal) Reaquecimento (Ferrita ou cementita) Martensita Revenida ( + Fe3C) Identificação das Fases Existem fronteiras onde há uma mudança abrupta de propriedades. Esses conjuntos de propriedades pertencem as fases presentes Micrografia de Compósito de Matriz metálica (Alumínio) com partículas cerâmicas Tipos de diagramas Binários Ternários Quaternários Binário Ternário Interpretação do diagrama Quais fases estão presentes? Qual é a composição das fases? Qual é a fração relativa das fases? Regra da alavanca A regra da alavanca é um método de determinação da quantidade de cada fase presente no material Regra da Alavanca C C0 S WL R S C CL Fração em peso de Líquido (WL) C0 CL R W R S C CL Fração em peso de sólido (Wα) Reações de Fases Reação Eutética Reação Eutetóide Reacão Peritética Temperatura (°C) Composição (at% Ag) L L (TE) Temperatura Composição (wt% Ag) Reação Eutética Resfriamento L(CE ) (CE ) (CE ) aquecimento Eutética Reação Eutética Líquido → Sólido α Microestrutura Eutética da Liga Nb (81.8%) – Si (18.2%): Nióbio é a fase clara, dispersa na matriz de Nb3Si + Sólido β Reação Eutetóide Sólido → Sólido γ + Sólido ε Exemplos de microestrutura Euteróide em Aços Crescimento de microestrutura Eutetóide em aço: http://www-g.eng.cam.ac.uk/mmg/teaching/typd/addenda/eutectoidmicrostructure1.html Reação Peritética Líquido + sólido A → sólido B Diagrama de Fases Parte II No Equilíbrio •Reações ocorrem com composições do líquido e do sólido homogêneas •Há tempo o suficiente para a difusão em ambas as fases Fora do equilíbrio •O primeiro metal formado é mais rico em soluto; •Não há tempo para que a difusão leve a composição química das fases à posição de equilíbrio; •A variação da concentração de soluto real desloca a linha Sólidus. Microestruturas Resultantes Diagrama de fases Chumbo - Estanho Segundo a regra da alavanca, haverão proporções específicas de fase e na composição acima, mas a morfologia depende do histórico de resfriamento •Concentração de soluto menor que a da linha Solvus. •Formação de grão de diretamente a partir do líquido. •Concetração de Soluto acima da linha solvus, mas abaixo da concentração mínima para Eutético (CE) •Nucleação de fase no interiror de grão já formados de •Concentração de Soluto igual a Composição Eutética da Liga •Formação de microestrutura eutética a partir do líquido L(61,9% p Sn) (18,3% p Sn) (97,8% p Sn) •Concentração de Soluto entre a Composição Eutética (CE) e CE; •Formação de grãos de a partir do líquido, mas havendo líquido remanescente ao chegar a Temperatura Eutética; •Formação de microestrutura eutética a partir do líquido, entre os grãos de Pré-Eutetóides; •Com composição entre CE e CE, a microestrutura é análoga. Diagramas com muitas transformações Diagrama Cobre - Zinco Compostos Intermediários Diagrama Ouro-Estanho Diagrama Ferro-Alumínio •Algumas ligas possuem compostos InterMetálicos: Composições específicas aonde os dois metais formam uma fase de estequiometria e cristalografia definida (substituição de átomos na rede em posições específicas). Ex: Cu3Sn, AuSn, FeAl2, Fe2Al5, etc... Diagrama Estanho-cobre Diagrama de Fases Parte III Transformações congruentes Reações Congruentes: Ocorrem quando um líquido da origem a um líquido de propriedades diferentes e mais uma fase sólida Diagrama Fe-Fe3C Ferrita (90x) Austenita (325x) Perlita (α + Fe3C) Microestrutura resultante do resfriamento rápido de uma liga composta de fase γ (austenita) com composição eutetóide (≈0,76% C) Aço eutetóide com microestrutura perlítica Liga eutetóide (≈ 0,76% C) Liga Hipoeutetóide Aço (0,38% C) com microestrutura composta de perlita e ferrita proeutetóide Liga Hipereutetóide Aço ( 1,4% C) com microsestrutura constituida de cementita proeutetóide (branca) que envolve as colônias de perlita Influência de outros elementos de liga Diagrama de fases dos materiais cerâmicos Lei das Fases de Gibbs P+F=C+N Onde: P= número de fases F= números de graus de liberdade C= componentes do sistema N= quantidade de variáveis não relacionadas com a composição (temperatura, pressão...) Pressão constante (1 atm) N = 1 (temperatura é a única variável) C= 2 ( Cu e Ag) Faz-se necessário especificar a temperatura e a composição para determinar o número de fases. Por exemplo: Para a temperatura T1 e composições entre Cα e CL , existem 2 fases ( α e líquida) P+F=C+N 2+F=2+1 F= 1 ( grau de liberdade) P= 2
Baixar