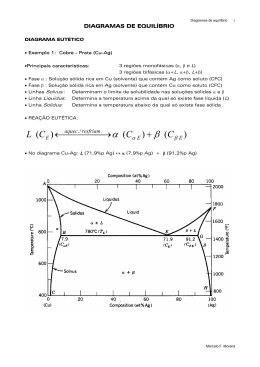
Diagramas de equilíbrio eutético e eutetóide Sistema eutético • Sistema que possui uma composição química entre os dois constituintes definida onde a fase líquida se decompõe em duas fases sólidas em determinada temperatura • L= α + β • A liga eutética possui ponto de fusão menor que os elementos da liga • A liga eutética se comporta como um metal puro na solidificação e na fusão, ou seja apresenta patamar de solidificação Características dos sistemas eutéticos • • • • • Esses diagramas tem pelo menos 3 regiões monofásicas α, β, e liquida.A fase α consiste em uma solução sólida rica em Cu sendo a Ag o soluto. A solução sólida β é rica em prata sendo o Cu o soluto. Os dois elementos são C.F.C. então tanto α como β também serão C.F.C. Nessas soluções a estrutura cristalina será a do elemento majoritário. A linha solvus CB marca o limite de solubilidade da Ag no Cu sendo que a linha solvus GH indica a solubilidade do Cu na Ag. As linhas sólidus indicam a temperatura para cada composição onde não há mais líquido presente As linhas liquidus indicam as temperaturas onde não há mais sólidos presentes Nesse sistema pode-se ver 3 regiões bifásicas. Desenvolvimento das microestruturas em ligas do sistema eutético Pb - Sn sujeitas a resfriamentos lentos Curva de resfriamento para uma liga fora da isoterma da reação eutética Desenvolvimento das microestruturas em ligas do sistema eutético Pb - Sn sujeitas a resfriamentos lentos Curva de resfriamento para uma liga eutética Desenvolvimento das microestruturas em ligas do sistema eutético Pb - Sn sujeitas a resfriamentos lentos • Representação esquemática da formação da estrutura eutética para o sistema chumbo – estanho. As transformações de fase envolvem difusão, que são dependentes do tempo. Desenvolvimento das microestruturas hipoeutéticas (as hipereutéticas são semelhantes mas a fase sozinha é a β) em ligas do sistema eutético Pb - Sn sujeitas a resfriamentos lentos Curva de resfriamento para uma liga hipoeutética, parte ocorre com uma troca de inflexão e parte em um patamar como se fosse um metal puro Ligas hipoeutéticas, eutética, e hipereutéticas Aplicação da regra da balança para os sistemas eutéticos • Em relação a liga com composição C4 na temperatura da reação eutética: • A fração do microconstituinte eutético We é a mesma fração do líquido WL q a originou • WL=We= P / P+Q • Fase α sozinha Wα=Q / P+Q • (primária ou pró-eutetica) • Fase α total Wαt=Q+R/P+Q+R • Fase β total Wβt = P / P+Q+R Cálculo da quantidade das fases e da composição das fases presentes logo abaixo da linha da reação eutética para a liga eutética com 61,9% de Sn. Cálculo da quantidade das fases e da composição das fases presentes logo abaixo da linha da reação eutética para a liga com 40% de Sn, sem considerar a estrutura eutética. Sistema eutetóide • Na reação eutetóide em uma mesma temperatura um sólido se transforma em outros dois sólidos distintos. • γ = α + β (no exemplo fase δ = γ + ε ) • Ponto eutetóide no gráfico ao lado (Cu - Zn) está na temperatura de 560º C na composição 74%Zn 26%Cu Ponto eutetoide para os aços Diagrama de equilíbrio com compostos intermetálicos • • • Para alguns sistemas em vez de soluções sólidas pode-se encontrar compostos intermediários ou intermetálicos no diagrama de fases. Esses compostos possuem fórmula química logo tendem a apresentar uma composição fixa, não admitindo grandes variações em função da mudança da temperatura, ou seja em geral aparecem como uma linha reta paralela à ordenada. No exemplo ao lado o composto intermetálico tem formula química Mg2Pb e terá sempre 19% de Mg e 81% de Pb (33% atômico de Pb)
Baixar