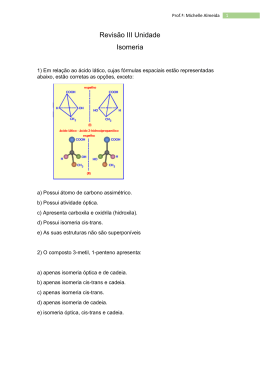
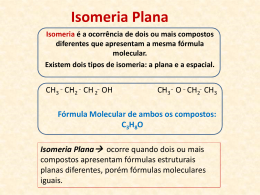
Isomeria é o fenômeno caracterizado pela ocorrência de duas ou mais substâncias diferentes, que apresentam a mesma fórmula molecular, mas diferentes fórmulas estruturais. O estudo dos compostos isômeros é dividido em Isomeria Plana, Geométrica e Ótica. Neste tipo de Isomeria, pode-se verificar a diferença dos isômeros através da análise de suas fórmulas estruturais. A Isomeria Plana divide-se em cinco classes : Isomeria de Cadeia ou Isomeria de Núcleo Isomeria de Posição Isomeria de Função Metameria ou Isomeria de Compensação Tautometria ou Isomeria Dinâmica Os isômeros fazem parte de uma mesma função, mas suas cadeias são diferentes. Obs: É claro que você não precisa saber as características químicas ou o uso de cada isômero (citadas na parte azul da tabela). Elas estão aqui apenas para que você perceba que a posição de um carbono modifica completamente o composto. Os isômeros pertencem à uma mesma função e têm o mesmo tipo de cadeia, mas apresentam diferença na posição do grupamento funcional, de uma ramificação ou insaturação. Isômeros de função são aqueles que possuem cadeias idênticas, mas pertencem à funções diferentes. Os isômeros pertencem a uma mesma função e apresentam cadeias idênticas, mas apresentam uma diferença na posição de um heteroátomo. Os principais casos de tautomeria (que vem do grego tautos = dois de si mesmo) envolvem os Enóis, que são Álcoois que possuem a Hidroxila (-OH) presa a um carbono insaturado. Os Enóis se transformam em Aldeídos quando o carbono insaturado é primário e em Cetonas quando o carbono é secundário. Os compostos originados a partir dos Enóis apresentam tendência a se transformar novamente nos Enóis, fazendo com que o ciclo se reinicie. A isomeria geométrica trata de casos onde há diferenças apenas na posição de alguns átomos em uma estrutura tridimensional. Nela, não importando o quanto se gire uma molécula, nunca é possível sobrepô-las perfeitamente. O composto 1,2-DicloroEteno pode ser representado de duas maneiras: C = Azul, H = Branco, Cl = Cinza É possível perceber que se tratam de duas estruturas diferentes, que não podem ser sobrepostas. Deve-se esperar que estas duas estruturas possuam características diferentes. Como pode-se então diferenciar estas duas estruturas? Antes de seus nomes utilizamse prefixos para indicar a posição de seus átomos ou radicais. A orientação é sempre dada a partir do maior número atômico para átomos iguais e maior número atômico (ou de tamanho, quando os números atômicos forem iguais) para radicais. O prefixo cis- indica que as partes de maior prioridade estão em uma mesma parte de um plano imaginário que corta a molécula. O prefixo trans- indica que as partes de maior prioridade estão em lados opostos da molécula. Observando a linha reta amarela traçada na estrutura da molécula, podemos perceber que os Com isso, o prefixo dois átomos de utilizado deverá ser Cloro estão em cis-. Esse é o cis-1,2lados iguais. dicloro eteno. O número atômico do Carbono é 6, do Bromo é 35 e do Hidrogênio é Se tivermos estes 1. Logo, a dois elementos em prioridade é um mesmo lado, o entre o prefixo será cis. Carbono e o Cis-2-bromo-2Bromo. buteno. Se tivermos estes dois elementos em lados diferentes o prefixo será trans. Trans-2-bromo-2-buteno. Aqui, temos o mesmo elemento, com o mesmo número atômico. Com isso, a prioridade é do radical etil e do metil. Cis-2-metil-2-penteno Se estiverem de um mesmo lado será cis e de lados opostos será trans. Trans-2-metil-2-penteno OBS.: Como você deve ter observado os compostos de cadeia aberta que apresentam isomeria cis- trans, necessitam de uma dupla ligação. Os compostos cíclicos possuem isomeria geométrica sem a necessidade de uma ligação dupla. Veja o exemplo do 1,2dicloro-ciclopropano. Observando a linha amarela, podemos perceber que os átomos de cloro tem a mesma direção na reta formam compostos cis. Os átomos de Cloro em direções opostas formam compostos trans. Acontece quando a estrutura molecular do composto é assimétrica. O que quer dizer composto assimétrico? A condição para que ocorra esse tipo de isomeria é que o composto apresente pelo menos um carbono quiral (é o carbono que apresenta quatro ligantes diferentes – costuma-se usar um asterisco (*) para identificar esse carbono). Um bom exemplo é o átomo de carbono tetraédrico em CHIBrCl. Na figura a seguir mostramos duas formas de arranjar quatro átomos diferentes em volta do átomo de carbono central: as duas formas não são superponíveis. O resultado é que formamos duas moléculas não superponíveis uma à outra, e de fato, uma é a imagem da outra refletida no espelho. ótima comparação é o das nossas mãos Uma : o reflexo no espelho da mão direita é igual à nossa mão esquerda, e vice versa. No nosso caso, acabamos de criar um par de isômeros óticos, ou enantiomeros. A orientação dos enantiomeros é representada pelas letras D (de dextro) e L (de levógiro, ou canhoto).
Baixar