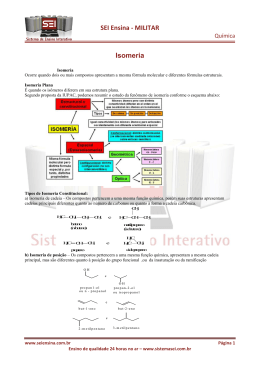
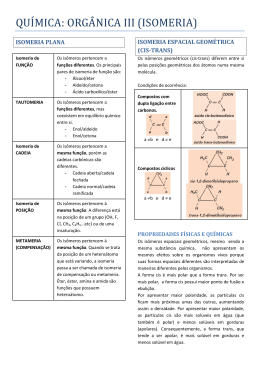
B)ISOMERIA ÓPTICA: -CONCEITO E HISTÓRIA:estuda o comportamento das substâncias quando submetidas a um feixe de luz polarizada,que pode ser obtida a partir da luz natural(não-polarizada). -LUZ NÃO-POLARIZADA:é um conjunto de ondas eletromagnéticas que vibram em vários planos,perpendiculares á direção de propagação do feixe luminoso. -LUZ POLARIZADA:é um conjunto de ondas eletromagnéticas que vibram ao longo de um único plano,denominado plano de polarização.Esse tipo de luz foi descoberto em 1808 pelo físico francês Malus,quando ele fez incindir um feixe de luz natural sobre um cristal transparente de uma variedade do carbonato de cálcio(espato da islândia).Essa propriedade é característica de várias substâncias,tanto naturais quanto sintéticas,que são denominadas polarizadores. Em 1815,o físico francês Jean-Batiste Biot percebeu que alguns líquidos orgânicos e algumas soluções aquosas de substâncias orgânicas(óleos de limão,cânfora em álcool,caldo de cana etc.)tinham a propriedade de desviar o plano de luz polarizada(plano de polarização).Biot verificou em alguns materiais provocavam um desvio no sentido horário e outros,no sentido antihorário em relação ao observador.Ele relacionou esse fenômeno com a assimetria da estrutura desses materiais. Biot não conseguiu criar um método para medir esses desvios.Mas,em 1829,o físico escocês Willian Nicol inventou um aparelho que denominou polarímetro.Apesar de Nicol ter descoberto uma maneira de medir o desvio sofrido,ele não conseguiu explicar por que isso ocorria.Em 1846,,o químico francês Louis Pasteur conseguiu estabelecer uma relação entre a assimetria estrutural e a capacidade de as substâncias desviarem-se no plano de polarização,que ocorreu durante seus estudos do processo de produção de vinho. Durante o processo de fermentação do suco de uva destinado á produção de vinho,formam-se dois ácidos que se depositam nas paredes dos barris.Pasteur descobriu que os cristais desses ácidos apresentavam comportamento diferente,quando submetidos á luz polarizada.O ácido tartárico desvia a luz para a direita,sentido horário; e o outro racêmico(do latim racemus=cacho de uvas),era inativo,isto é ,não provoca desvio;os dois ácidos apresentam a mesma fórmula molecular e as mesmas propriedades,mas tem atividade ópticas diferentes. Estudando os cristais dos sais de sódio e do amônio do ácido tartárico,Pasteur percebeu que eles eram assimétricos,apresentando de cada lado uma face diferente;os racêmicos também não eram simétricos,mas alguns tinham uma face diferente para a direita e outros para a esquerda,de modo que os dois tipos se comportavam como um par de objeto-imagem em relação ao outro.Pasteur separou cuidadosamente os dois tipos de cristais que compunham o racêmico e dissolveu-os separadamente em água.Analisando essas soluções,verificou que ambas eram opticamente ativas:uma desvia para a direita e a outra para a esquerda(em mesmo ângulo).Isso concluiu que o ácido racêmico não é uma substância pura,mas uma mistura formada por: -50% de um tipo de ácido tartárico,que desviava o plano de polarização para a direita(dextrógiro); -50% de um outro tipo de ácido tartárico,que provocava um desvio de mesmo valor para a esquerda(levogiro). Ele percebeu que deveria existir outro motivo para explicar a atividade óptica,além da assimetria dos cristais,pois ela continuava existindo mesmo em solução.A diferença entre substâncias de mesma fórmula molecular,mas com atividades ópticas diferentes,denominadas isômeros ópticos,só foi esclarecida com o modole tetraédrico do carbono,roposto em 1874 por Le bel e Van’t Hoff.Se átomo de carbono ocupar o centro de um tetraedro e seus vértices estiverem ocupados por quatro ligantes diferentes,pode–se admitir a existência de duas moléculas diferentes e assimétricas. CONCEITO DE SIMETRIA:dizemos que uma estrutura é simétrica quando ela apresenta pelo menos um plano de simetria,isto é,quando pode ser dividida em duas metades idênticas.Uma estrutura simétrica,quando colocada diante de um espelho plano,produz uma imagem idêntica a ela.Estruturas que não admitem nenhum plano de simetria são denominadas assimétricas;quando colocadas diante de um espelho plano,as estruturas assimétricas produzem imagens diferentes de si próprias.uma característica importante dessas estruturas é que elas não são sobreponíveis. -ASSIMETRIA MOLECULAR E A ISOMERIA ÓPTICA: A condição necessária para a ocorrência de isomeria óptica é que a molécula da substância seja assimétrica.O caso mais importante de assimetria molecular ocorre quando há,na estrutura da molécula,pelo menos um carbono assimétrico ou quiral (do grego cheiral=mão).Um átomo de carbono é considerado assimétrico,quando ele apresenta quatro grupos ligantes diferentes entre si,esse fato é indicado por um asterisco(*). A presença de um carbono assimétrico(quiral)em uma molécula garante a existência de duas estruturas não-sobreponíveis,que correspondem a duas substâncias denominadas isômeros ópticos.Esses isômeros têm a capacidade de desviar o plano da luz polarizada de mesmo ângulo,mas em sentidos opostos,e são denominados opticamente ativos. EXEMPLO:ácido láctico,encontrado no leite azedo e nos músculos. Esses isômeros são quimicamente e fisicamente iguais;a única maneira de saber se um isômero óptico é dextrógiro(d) ou levogiro(l) consiste em utilizar um polarímetro;é impossível obter tal informação pela simples análise da fórmula estrutural do isômero.Dois isômeros opticamente ativos [(d) e (l)],que apresentam o mesmo ângulo de desvio,são denominados antípodas ópticos ou enantiomorfos e sua mistura em qunatidades equimolares resulta numa mistura opticamente inativa,denominada mistura racêmica,conhecida também por isômero racêmico[(dl) ou (r) ]. QUANTIDADE DE CARBONOS ASSIMÉTRICOS E NÚMERO DE ISÔMEROS ÓPTICOS -Moléculas com um carbono quiral (C*): possui 2 isômeros opticamente ativos(IOA) e 1 isômero opticamente inativo(IOI). -Moléculas com vários carbonos assimétricos diferentes:expressões matemáticas propostas por Van’t Hoff e Le Bel. -Moléculas com carbonos assimétricos iguais:nesses casos não podem aplicar as expressões matemáticas de Van’t Hoff e Le Bel para determinar o seu número de isômeros.Exemplo: àcido tartárico(2,3-dihidroxi-butanóico). -Moléculas cíclicas:a isomeria óptica também ocorre em compostos cíclicos,em função da assimetria molecular.Embora nessas moléculas não existam carbonos assimétricos,para determinar o número de isômeros deve-se considerar a sua existência. -Moléculas assimétricas: na maioria dos processos biológicos,somente um dos isômeros ópticos é ativo.Por exemplo, o isômero dextrógiro do LSD causa alucinações,ao passo que o isômero levogiro não produz nenhum efeito.No final da década de 50,um medicamento chamado Talidomida foi prescrito como tranqüilizante para gestantes em muitos países;ele produziu efeitos trágicos,originando crianças sem membros ou com membros deformados;a Talidomida apresenta isomeria óptica,e o medicamento continha uma mistura racêmica,foi descoberto posteriormente que o isômero(l)era o responsável por tais deformações.Existem outros casos de isomeria óptica que envolvem estudos particularizados das suas estruturas e que não são considerados importantes para o nosso curso.
Baixar