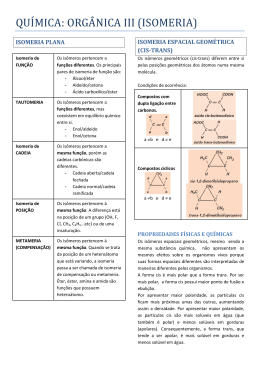
Isomeria Profa. Kátia Aquino O que são isomeros? O termo Isomeria vem do grego (iso = mesma(s); meros = partes). Partes iguais para transmitir a idéia de “mesma composição”. A Isomeria é o fenômeno pelo qual duas substâncias compartilham a mesma fórmula molecular, mas apresentam estruturas diferentes, ou seja, o rearranjo dos átomos se difere em cada caso. etoxi-etano metoxi-n-propano Divisão da isomeria para estudo Isomeria plana Isomeria Espacial: geométrica e ótica I Isomeria plana 1-Isômeros de posição http://br.oocities.com/kfsn2000/isomeria.htm 1.1-Isômeros de posição: metameria Acontece quando há mudança de posição de um heteroátomo na cadeia principal. 2-Isômeros de função http://br.oocities.com/kfsn2000/isomeria.htm 2.1-Isômeros de função: Tautomeria Existe equilíbrio dinâmico entre as moléculas http://www.infoescola.com/quimica/isomeria/ 3-Isômeros de cadeia normal http://www.colegioweb.com.br/quimica/isomeria-de-cadeia-.html ramificada II Isomeria Espacial Geométrica Os carbonos ligados em uma cadeia fechada ou ligados por insaturações não possuem rotação livre. http://br.oocities.com/kfsn2000/isomeria.htm Origem dos nomes na isomeria geométrica Latim cis=próximo a trans=através de Alemão Z E (zusammem)=juntos (entgegen)=opostos A nomenclatura Z e E é utilizada principalmente para moléculas cujos quatro ligantes dos carbonos que não sofrem rotação são diferentes. Isômeros cis e trans Cadeia aberta Cadeia fechada Isômeros Z e E Perceba que os quatro ligantes são diferentes. Em amarelo estão os ligantes com átomos de maior número atômico ligados aos carbonos insaturados. Propriedades físicas dos isômeros geométricos Quem tem maior ponto de ebulição: cis-buteno ou trans buteno? Cis-buteno : 4°C Trans-buteno: 1°C Outro exemplo: Descrição geral O isómero trans é, no geral, é termodinamicamente mais estável que o isômero cis, apresenta menor polaridade e menor ponto de ebulição. No entanto, o isómero trans é, no geral, mais facilmente “empacotável” quando está no estado sólido, apresentando maior ponto de fusão. Vejamos um exemplo das propriedades de isômeros no estado sólido http://quimica-dicas.blogspot.com/2009/11/isomeria-espacial-geometrica.html Uma aplicação da isomeria geométrica Olho humano http://www.eyetumour.co.uk/ocular_tumour_treatment.php http://www.quimica.seed.pr.gov.br/modules/conteudo/conteudo.php?conteudo=27 No olho humano, especificamente na retina, o cis-11- retinal se transforma no trans-11- retinal pela ação da luz e assim produz Impulso elétrico para formar a imagem. Por isso você precisa de luz para enxergar. Feromônio sintético Uma solução para o controle de moscas? Z-9-TRICOSENE ou Cis-9-TRICOSENE O Z-9 TRICOSENE, atua como atrativo sexual das moscas domésticas, simulando o feromônio sexual. Empregado junto com outras substâncias, atua no controle deste inseto. http://clarionbio.com.br/produto.php?id=321 III Isomeria Espacial Óptica Luz polarizada ativa inativa http://www.ifi.unicamp.br/~accosta/roteiros/18/nota %2018.html Substância química Substância polarizadora: Lente polaróide ou prisma de Nicol O que significa ser um isômero óptico? A diferença entre isômeros ópticos está no sentido para o qual desviam o plano de vibração da luz polarizada: para o sentido horário (dextrogiro) e para o sentido antihorário (levogiro) Compostos oticamente ativos São aqueles que possuem pelo menos um carbono assimétrico, fornecendo assim um isômero que é a sua imagem especular. Na química: http://www.mundoeducacao.com.br/quimica/isomeria-optica.htm Composto inativo Composto ativo Moléculas assimétricas 1-Carbono quiral (mão em grego) Carbono que possui quatro ligantes diferentes * * Quando uma molécula possui apenas um carbono quiral Par de enantiomorfos dextrogiro e levogiro http://quimica-dicas.blogspot.com/2009/11/isomeria-optica.html Mistura racêmica: Quando Partes iguais de enantiomorfos são misturadas. A Mistura racêmica é oticamente inativa. Àcido láctico: O ácido do leite Os dois antípodas (enantiomorfos) acima desviam a luz polarizada no mesmo ângulo Moléculas com mais de um carbono quiral 1-Carbonos quirais diferentes 3-metilpentan-2-ol Carbono 2= gira a luz polarizada com ângulo de 30° Carbono 3= gira a luz polarizada com ângulo de 10° Quantos isômeros oticamente ativos e misturas racêmicas Temos para este composto? Regra de van't Hoff O números de isômeros óticos ativos é igual a 2c*, onde c* é o número de átomos de carbono assimétrico diferentes existentes na molécula. Logo o número de misturas racêmicas é sempre a metade do número de isômeros ópticos ativos. Enantiomorfos ou diastereoisomeros? A diferença entre os quatro compostos é indicada pelas posições dos grupos OH e CH3, que as vezes estão na esquerda e outra vez à direita da fórmula. Observe que A e B; C e D são imagens especulares uma da outra. É como se houvesse um espelho na frente de cada uma destas moléculas. Os isômeros ópticos que não são enantiomorfos entre si são chamados de diastereoisômeros. Neste caso são A e C; A e D; B e C; B e D. http://www.soq.com.br/conteudos/em/isomeria/p5.php 2-Carbonos quirais iguais curiosidade: Ácido tartárico: o ácido do vinho http://www.scielo.br/scielo.php? script=sci_arttext&pid=S010384782001000500027&lng=en&nrm=iso&tlng=pt pt 2-Compostos alênicos Exemplo: http://www.colegioweb.com.br/quimica/isomeria-optica-em-composto-sem-carbonoassimetrico 3-Compostos trans de cadeia fechada F Cis Oticamente inativo Trans Oticamente ativo Como separar os enantiomorfos? 1- A similaridade de propriedades físicas e químicas entre pares de enantiómeros em meios aquirais torna a sua diferenciação e separação muito laboriosas. Dada a sua alta eficiência, os processos cromatográficos de alta resolução são o método de escolha. O processo mais simples e mais antigo para levar a cabo a separação de dois enantiómeros consiste em transformá-los em diasterómeros, ou seja, isómeros configuracionais que não são a imagem especular um do outro: http://www.dq.fct.unl.pt/qof/stereo5.html R (rectus = direita) S (sinester = esquerda) 2-Recristalização Os cristais de enantiomorfos são diferentes entre si http://www.coladaweb.com/quimica/quimica-organica/recristalizacao A isomeria para os seres vivos A glicose, que é uma aldose, possui vários isômeros oticamente ativos. A isomeria para os seres vivos α=cis β=trans α-glicopiranose β -glicopiranose α-glicofuranose β -glicofuranose Mutarrotação +113° +52° +19° [α]d20°C = rotação específica Toda solução de glicose contem as três estruturas coexistindo simultaneamente Açúcar invertido: O açúcar que muda de “ótica” d-sacarose + água dextrogiro (+66°) d-glicose + l-frutose levogiro (-39,7°) Objetivo: evitar que o açúcar cristalize nos alimentos Bons estudos!!
Baixar