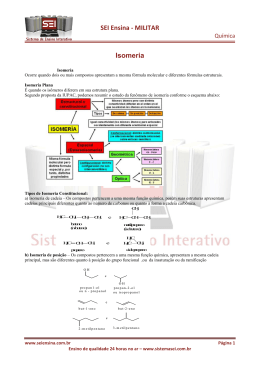
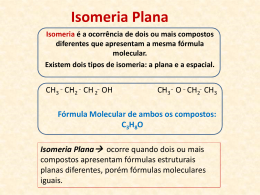
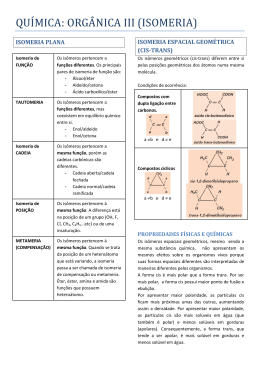
QUÍMICA DA VIDA: QUÍMICA ORGÂNICA E BIOLÓGICA Lucas Frederico Jardim (15773) Thiago Pereira Silva (15786) Prof. Élcio R. Barrak 1/28 Introdução • • • • • Química Orgânica Isomeria Reações Bioquímica Aplicações no cotidiano 2/28 Química Orgânica • Química orgânica: Em 1828, o químico Friederich Wohler sintetizou uma substância orgânica (Uréia), a partir de uma substância inorgânica (Cianato de Amônio). • Com isso ficou provado que a misteriosa força vital não existia, e que “substâncias orgânicas” poderiam ser produzidas na ausência de organismos vivos. • Atualmente, química orgânica é definida como a química que estuda as propriedades, reações e estruturas da maioria dos compostos do carbono 3/28 Aspectos importantes que devem ser considerados nas estruturas dos compostos orgânicos 4/28 Identificação das principais funções orgânicas 5/28 Regras de nomenclatura • Identificação da cadeia carbônica principal: deve conter os carbonos aos quais estão ligados os grupos funcionais. Depois de identificados, seguimos como se estivéssemos marcando a cadeia principal de hidrocarbonetos. • Numeração da cadeia principal: depois de marcada a cadeia principal, iniciamos a numeração à partir da extremidade mais próxima do grupo funcional, caso exista necessidade. 6/28 Nomenclatura das substâncias: para darmos nome às substâncias pertencentes às funções citadas anteriormente, devemos identificar a cadeia principal, numerála (quando necessário) e observar a seqüência abaixo: 7/28 citar a posição do radical (quando necessário) ; Escrever o nome do radical Escrever o nome do prefixo seguido do infixo Citar posição do grupo funcional (quando necessário Escrever o nome do sufixo que identifica a função Compostos cíclicos • Ciclanos: compostos cíclicos formados por apenas carbonos saturados. • Ciclenos ou cicloolefinas: compostos cíclicos que contêm carbono insaturado. • Aromáticos: compostos derivados do Benzeno 8/28 Isomeria • Isomeria: Compostos que possuem a mesma fórmula molecular. A isomeria pode ser classificada em Plana e Espacial: • Isomeria Plana: a diferença entre os compostos pode ser identificada através da fórmula estrutural plana. • Isomeria Espacial: a diferença entre os compostos pode ser identificada através da fórmula espacial. 9/28 Tipos de isomeria • Isomeria de cadeia: os isômeros de cadeia possuem mesma fórmula molecular, mesma fução e cadeias carbônicas diferentes •Isomeria de posição: os isômeros de posição possuem grupos funcionais, insaturações, ou radicais localizados em posições diferentes na cadeia. 10/28 • Isomeria de função: os isômeros funcionais possuem funções diferentes • metameria: a diferença entre os isômeros está na posição do heteroátomo. 11/28 • Isomeria tautomeria ou dinâmica: verificamos a existência desse tipo de isomeria quando dois compostos de grupos funcionais diferentes e mesma fórmula molecular coexistem em equilíbrio dinâmico, ou seja, um composto esta se transformando continuamente no outro e vice-versa. 12/28 • Isomeria geométrica, ou cis-trans: ocorre em compostos desde que sejam observadas as seguintes condições: Isômeros cis: os grupos de maior massa, sendo um de cada carbono, estão do mesmo lado do plano.Isômeros Trans: os grupos de maior massa, sendo um de cada carbono, estão em lados opostos do plano. 13/27 • Isomeria óptica: ocorre em substâncias com assimetria molecular. Em geral a assimetria molecular está relacionada a presença de um ou mais carbonos assimétricos (quirais). – Enantiômeros: par de isômeros ópticos ativos. – Levógiros: isômeros que giram o plano da luz para a esquerda – Dextrógiros: isômeros que gira o plano da luz para a direita 14/28 Reações Orgânicas • Hidrogenação Catalítica: O gás hidrogênio, na presença de catalisadores metálicos como Ni, Pt, Pd, rompe a ligação Pi de alcenos, dienos e alcinos, transformando-os em compostos com menos insaturações, ou saturados. 15/28 • Redução de aldeídos e cetonas: eles também reagem com hidrogênio em presença de catalisadores metálicos. • Adição de X2: 16/28 • Adição de HX: nessa reação verifica-se experimentalmente que o Hidrogênio do HX adiciona-se ao carbono mais hidrogenado da dupla ligação (regra de Markownikoff). 17/28 • Esterificação : trata-se da reação entre ácido carboxílico e álcool para produzir éster e água, como catalizador, um meio ácido. • Saponificação: é a hidrólise do éster em meio básico. A diferença entre detergente e sabão está na parte polar, uma vez que os sabões são sais de ácidos carboxílicos e os detergentes, sais de ácidos 18/28 sulfônicos. • Desidratação intramolecular: essa reação obedece a regra de Saytzeff que diz: ” O H é retirado, preferncialmente, do carbono menos hidrogenado entre aqueles que estão ligados ao carbono da hidroxila”. • Desidratação intermolecular: 19/28 • Oxidação de álcoóis e aldeídos: Essas reações ocorrem em presença de oxidantes como KMnO4 ou K2Cr2O7, concentrado em meio ácido e quente. Bioquímica • Carboidratos: existem três tipos de carboidratos: • Monossacarédeos 21/28 • Dissacarídeos: a hidrólise da sacarose ocorre na presença de sacarase, e produz frutose + glicose • Polissacarídeos: é constituído de muitas unidades de monossacarídeos. • Amido: é um grupo de polissacarídeos encontrado nos vegetais e funciona como principal método de armazenar alimento em sementes e tubérculos vegetais. • Glicogênio: substância semelhante ao amido sintetizada no corpo e age como espécie de reserva de energia no corpo. • Celulose: composto orgâncio mais abundante na biosfera. 22/28 • Proteínas: as proteínas são macromoléculas biológicas constituídas por aminoácidos, cuja fórmula é: 23/28 • ácidos nucleícos: o ácido desoxirribonucléico (DNA), ao sofrer hidrólise, produz ácido fosfórico, Desoxirribose (Pentose), Adenina, Guanina, Citosina e Timina. Já o ácido Ribonucléico ao sofrer hidrólize, produz ácido fosfórico, Ribose (Pentose), Adenina, Guanina, Citosina e Uracila. 24/28 25/28 Aplicações no cotidiano 26/28 27/28 Referências Bibliográficas: • Lastro Editora Ltda • Química: A ciência central • http://br.youtube.com/watch?v=5ZokhiVmDVM. • http://br.youtube.com/watch?v=z1R_YbwH VJk. 28/28
Baixar