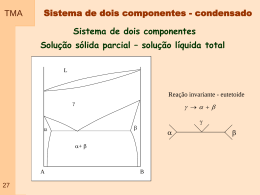
TMA As Relações de Maxwell dU TdS PdV Matemática: dH TdS VdP f f ( x , y) dA SdT PdV dG SdT VdP 01 df gdx hdy Se e somente se, g h y x x y T P V S S V S P V T T V T V P S S P S V P T T P TMA EXERCICIO Considere um bloco de ferro puro a 298 K.: a) Qual o volume molar do ferro? b) Determine uma equação para a variação da entropia com a pressão a temperatura constante para um sólido, expressa em termos de parâmetros mensuráveis, como os apresentados abaixo. c) Sabendo que a entropia molar do ferro a 298 K e 1 atm está disponível em handbooks, e é de 27,28 J/Kmol, qual o valor da entropia molar do ferro a 298 K e 100 atm. Qual o erro percentual assumido se considerarmos a entropia como constante neste intervalo de pressão. Dados: Cp = 24 J/Kmol Compressibilidade = 6x10-7 /atm Coeficiente de expansão térmica linear = 15x10-6 /oC Densidade = 7,87 g/cm3 Peso molecular = 55,85 g/mol 01a TMA Outras Relações importantes dG SdT VdP dV VdT VdP dU Cp PVdT VP TdP dH CpdT V1 TdP dA S PVdT PVdP Cp dS dT VdP T 02 Energia Livre de Helmholtz - Gibbs TMA Sistema em equilíbrio térmico com as vizinhanças–temperatura T Ocorre mudança de estado com transferência de calor Processo espontâneodS sis ds viz 0 dq dS 0 T Volume Constante 032 Pressão Constante dSU,V 0 dSH,P 0 dUS,V 0 dHS,P 0 dU TdS 0 dH TdS 0 TMA 04 Energia Livre de Helmholtz - Gibbs dU TdS 0 dH TdS 0 dA T dG T dAT,V 0 dG T,P 0 Energia Livre de Gibbs TMA Relação entre energia de Gibbs e temperatura a pressão constante G S T P 05 Energia Livre de Gibbs TMA G S T P GH G T T P G H 2 T T T P 06 G H 2 T T T P G H TS GH S T G H G T P T T Equação de Gibbs - Helmholtz Energia Livre de Gibbs TMA Relação entre energia de Gibbs e pressão a temperatura constante G V P T 07 Energia Livre de Gibbs TMA Relação entre energia de Gibbs e pressão a temperatura constante Pf G V P T G VdP dG VdP Pi Pf G Pf G Pi VdP Pi Sólidos e liquidos Gás ideal 08 GPf GPi VP Pf GPf G Pi nRT Ln Pi Gás ideal-Pi= Ppadrão P GPf G nRT Ln f P TMA 09 TMA Potencial Químico É uma medida de quanto varia a energia livre de um sistema quando se adiciona a ele uma quantidade de substancia Considera a possibilidade de transferência de massa G n T ,P dU q W ndUn Sistema contendo dois componentes G G B dU q W n AdU A n BdU B A n B n iBT ,P n A n iA T ,P Sistema contendo n componentes 10 dU q W nidUi G i n i n i jT ,P Potencial Químico TMA G Gm n T,P Pf GPf G nRT Ln P Pf Pf RT Ln P Pf RT LnPf 11 Fugacidade TMA Fugacidade esta associado com quanto o comportamento de um sistema foge da idealidade A dependência químico Gás Ideal e Pf Pf RT Ln P Gás Real f Pf RT Ln f Medida da tendência a escapar do comportamento ideal 12 a pressão mesma pressão potencial deve ser adaptada no caso de gases reais PV nRT Tem entre dimensão que a Estado Padrão TMA O estado padrão de um gás real é um estado hipotético em que o gás está na pressão po e tem o comportamento de gás perfeito Relação entre fugacidade e pressão f p P RT ln RT ln P 132 TMA 14 Relação entre fugacidade e pressão TMA Atividade Definida com base na fugacidade. É a razão entre a fugacidade do material em relação a fugacidade no estado padrão, em uma mesma temperatura. O estado padrão para o gás é o material puro na pressão de 1 bar. Para líquidos e sólidos é considerado o material puro na pressão de 1 atm f Pf nRT Ln f 15 TMA Equilíbrio Segunda lei da termodinâmica: a entropia do universo tende a permanecer constante ou a aumentar. Para um sistema isolado a entropia deste deve aumentar ou permanecer constante; Questão 1 : Existe um máximo para a entropia? Questão 2 : O que e equilíbrio? Existe uma relação entre equilíbrio e forca motriz No equilíbrio as propriedades macroscópicas do sistema permanecem constantes tornando-se independentes do tempo Quando nos aproximamos do equilíbrio a taxa de aumento da entropia diminui 16 TMA Equilíbrio Em um sistema isolado, a entropia e máxima no ponto de equilíbrio Equilibrio Térmico A temperatura de um sistema e uma medida do potencial ou intensidade de calor do sistema. E uma medida da tendencia de transferencia de calor no sistema. Duas partes do sistema com temperaturas diferentes ( gradiente de temperatura) possuem uma forca motriz para o fluxo de calor. O equilibrio termico e atingido quando nao existe gradiente de temperatura no sistema. 17 TMA Equilíbrio Equilibrio e Pressão A pressao de um sistema e uma medida da tendencia de movimento; Se a pressao exercida por uma fase sobre o sistema, e maior que o de outras, existe uma tendencia de expansao de uma fase em relacao a outra; O equilibrio ocorre quando a pressao em todo o sistema e constante Equilíbrio e Potencial Químico 18 O potencial quimico de um componente em uma fase e uma medida da tendencia de difusao deste componente para outra fase. se os potenciais quimicos de um componente de diferentes fases do sistema forem diferentes, existira uma tendencia a difusao deste componente de uma fase para outra O equilibrio ocorrera quando o compoente estiver distribuido de tal forma entre as fases de forma a que todas tenham o mesmo potencial quimico Equilíbrio TMA -Temperatura constante (equilíbrio térmicos) -Pressão constante (equilíbrio mecânico) -Potencial químico constante (equilíbrio químico) -Mínima -Mínima -Mínima -Máxima 19 entalpia energia livre de Helmholtz energia livre de Gibbs entropia Exemplo de equilíbrio – H2O TMA A 1 atm água e gelo estão em equilíbrio a 0 C, quando a variação de energia livre de Gibbs molar e mínima. Se calor e fornecido e gelo e convertido e água líquida o equilíbrio não é alterado pois o potencial químico das duas fases e o mesmo Pressão constante Pressão constante Líq uid o G 20 T Tm 0 G(sl) Sól ido T Tm G=H-TS TMA 30 TS (kJ) 28 H (kJ) 4 (l) H 2O 2 26 24 0 ) O (l H2 22 -2 20 -4 H 2O (s) -6 18 16 O (s) H2 -8 14 250 275 T (K) 300 325 350 12 10 250 275 300 T (K) 21 325 350 H(s-l)=Tm S TMA (s-l) (kJ)10 9 8 7 6 5 4 1 0 -1 250 275 300 T(K) 22 325 350 TMA Pressão -temperatura Temperatura constante Temperatura constante 0 C G T G 0,0075oC 0,006 atm P 1 atm P 0oC, 1atm 23
Baixar