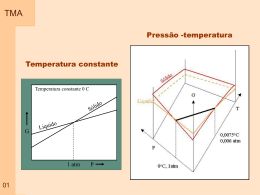
TMA Diagrama energia livre -Define composições em que as fases ou misturas de fases são mais estáveis - Deve-se obter uma curva para cada temperatura -Linha pontilhada : considera a existência de A e B separadamente – condição de imiscibilidade -Linha contínua: corresponde à formação de solução 01 TMA Construção do diagrama -Microscopia : permite a identificação das fases determinar as temperaturas limites de transformação -Difração de raios-X: -Análise térmica: método elementar por resfriamento em câmara com atmosfera controlada. material contido em cadinho isolado medida da temperatura utilizando termopar -Análise dilatométrica: -Pode se medir outras propriedades : Elétricas ( determinar limite de solução sólida); --Medidas de energia livre 02 TMA 03 Temperatura A 2900 A 2800 2700 2600 2500 2400 B 2300 2200 2100 2000 B C 1900 D A A B C B C C D D Tempo TMA Sistema de dois componentes Temperatura – Pressão - Composição 04 TMA Sistema de dois componentes - condensado Temperatura - Composição Pressão = 1 atm Temperatura Líquido A+B A 05 Composição B TMA Sistema de dois componentes - condensado Sistema de dois componentes Sem solução 06 Miscibilidade total TMA F T1 T2 Líquido -O termo associado a calor (entalpia) tem menor influência, sendo a força motriz o aumento de entropia (componente –ST) - Ligas ( misturas) que seguem a lei de Hume-Rothery formam solução sólida total T3 T1 T4 T5 Sólido A F F Sólido B Líquido 07 A B TMA 08 Miscibilidade total Miscibilidade total TMA T2 F Sólido F T1 T2 Líquido Líquido T3 A B T4 T5 T3 F Sólido A B Sólido Líquido 09 A B Miscibilidade total TMA F T4 F T1 T2 Líquido Líquido Sólido T3 A T4 B T5 F T5 Sólido A B Líquido Sólido 10 A B TMA Miscibilidade total Ni Cu Solução - Líquido Ni Cu Solução Sólida 11 TMA Sistema de dois componentes Solução sólida total – solução líquida total Sistema Isomórfico: é aquele onde os componentes são solúveis em todas as proporções e em todos os estados, sólido, líquido e gás A linha que divide as regiões de equilíbrio de L e L+ é dita Linha líquidus a linha que divide as regiões de equilíbrio L+ e é dita Linha solidus. A linha líquidus define a composição da fase líquida para qualquer temperatura enquanto a linha sólidus define a composição da fase sólida. 12 TMA 13 Sistema Cu-Ni TMA Sistema de dois componentes Solução sólida total – solução líquida total Sistema Isomórfico: é aquele onde os componentes são solúveis em todas as proporções e em todos os estados, sólido, líquido e gás No estado sólido podemos ter solução sólida substitucional e solução sólida intersticial (1) Substitucional – O soluto ocupa posições na estrutura cristalina, em sustitução a um dos átomos do solvente. (2) Intersticial – o soluto entra em um dos espaços vazios (vacâncias) entre os átomos da estrutura cristalina do solvente. Estrutura cristalina: Ambos, soluto e solvente devem ter mesma estrutura cristalina para que a substituição possa ocorrer progressivamente, sem que ocorra mudança de fase. 14 TMA Aplicação da regra de Gibbs: Aplicação da regra da alavanca – definição da Tieline ou linha conjugada: Na Composição 1 -% em peso de Cu e % em peso de Ni -% atômica de Cu e % atômica de Ni - a 1500 C , quantas fases estão em equilíbrio e qual o grau de liberdade. -A 1500 C, qual a composição das fases presentes -A 2300 F, quantas fases estão em equilibrio e qual o grau de liberdade. -A 2300 F, qual a composição das fases presentes -A 2300 F, qual a porcentagem em peso de cada fase presente -A 1050 C, quantas fases estão em equilíbrio e qual o grau de liberdade. -A 1050 C, qual a composição das fases presentes 15 Regra da Alavanca TMA Co- Cl Cl Cl- Ce Ce Co- Ce Co Amostra Composição da fase A 16 Composição da fase B TMA Sistema de dois componentes Solução sólida total – solução líquida total 17 TMA Resfriamento lento - Equilíbrio Quando existem duas fases em equilíbrio estas são ditas fases conjugadas e a linha isotérmica que as une é conhecida como linha conjugada. 18 TMA 19 TMA Resfriamento rápido – Fora do equilíbrio Tratamento térmico de homogeneização: O gradiente de concentração gerado durante o resfriamento pode ser eliminado através de um tratamento térmico, realizado em temperatura abaixo da temperatura da linha sólidus (levando-se em consideração os possíveis deslocamento), por período de tempo adequado a permitir o processo de difusão e homogeneização da composição do sólido. 20 TMA Resfriamento rápido – Fora do equilíbrio Consequências do resfriamento fora do equilíbrio: -Aumenta o intervalo de temperatura em que líquido e sólido coexistem -Gera gradiente de composição na liga (solução sólida) produzida -Quanto menor a taxa de aquecimento menor o intervalo de temperatura de equilíbrio sólido – liquido -Quanto maior a taxa de difusão do material, menor o efeito de gradiente de composição -A microestrutura resultante é formada por grãos onde a temperatura de fusão no centro do grão é maior que a temperatura de fusão no contorno de grão 21 TMA Resfriamento rápido – Fora do equilíbrio Liga Al-Cu (4%) 22 TMA 23 Exemplo – Produção de Jóias TMA Ponto de fusão congruente Em alguns casos as curvas líquidus e sólidus apresentam ponto de máximo ou mínimo. Neste ponto as linhas líquidus e sólidus devem se encontrar e estes pontos são definidos como Pontos de fusão congruente de ligas L A Temperatura Temperatura L B A B -Sistemas Isomórficos: Ag-Pd, Bi-Sb, Co-Ti, Mo-Ta, Mo-Ti, Mo-V, Mo-W, Hf-Zr -Sistemas Isomórficos com ponto de mínimo: Cb-Hf, Cb-V, Co-Pd, Co-Pt, Au-Cu, Au-Ni, Cs-K, Cr-Mo, Ti-V, Cr-Mo, Ti-Zr, K-Rb, Ni-Pd, Cr-V 24 -Sistemas Isomórficos com ponto de máximo: em metais são desconhecidos, sendo possíveis em não metálicos TMA Sistema de dois componentes - condensado Sistema de dois componentes Solução sólida parcial – solução líquida total 25 TMA Exemplo – Produção de Jóias Transformações de ordem desordem 25a TMA Exemplo – Produção de Jóias Sistema de dois componentes Com Solução solida total em um intervalo de temperatura e Gap de miscibilidade Ouro branco – Niquel / Prata e Paladio 25b TMA Sistema de dois componentes - condensado Sistema de dois componentes Solução sólida parcial – solução líquida total T1 Reação invariante - eutética L L 26 TMA Sistema de dois componentes - condensado Sistema de dois componentes Solução sólida parcial – casos extremos 27 TMA Sistema de dois componentes - condensado Sistema de dois componentes Solução sólida parcial – casos extremos 28
Baixar