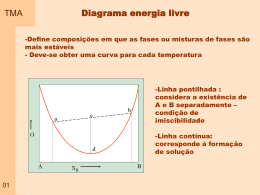
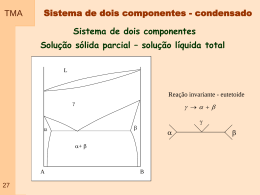
TMA Pressão -temperatura Temperatura constante Temperatura constante 0 C G 1 atm 01 P TMA Três reações (a), (b) e (c) Equilibrio em reações 02 TMA Sinterização Solidificação em metais 03 TMA Substâncias Puras Conceito de substâncias puras Análise de transições de fase Significado de diagramas de fase 04 Fase TMA Fases mais lembradas Sólido - Líquido - Vapor Solidos cristalinos material cuja estrutura cristalina é definida através de um arranjo periódico e tridimensional de átomos ou ions; os metais e as ligas metálicas constituem exemplos de materiais sólidos cristalinos; 05 a maior parte dos metais cristaliza, ao solidificar, em três struturas cristalinas compactas: CCC, CFC e HC. Fase TMA Materiais Geralmente são policristalinos os materiais em engenharia são formados por pequenos cristais com tamanhos da ordem do micron (milésima parte do milímetro – 10-6m) Transformação de fase mudanças de estrutura que ocorrem com a variação da temperatura, pressão e omposição 06 Podem ocorrer por difusão ou deslocamento de curta distância TMA Equilíbrio químico entre fases tem a ver com potenciais químicos semelhantes G Gm n T,P G S T P Gm Sm T P T P 07 EXEMPLO: Considere água a P=1 atm -Gelo é estável se T < 0 C - μ gelo< μ líquido -Água estável quando T > 0 C μ gelo > μ líquido -Temperatura de Transformação T trs: Temperatura em que os potenciais são iguais, μ ice= μliquid waterat T = 0oC TMA Relação equilíbrio tempo Transição depende da espontaneidade termodinâmica e da velocidade Conceito de fase metaestável Curvas de equilíbrio Diagramas de fase Diagramas de equilíbrio Mostra as regiões de pressão e de temperatura em que as diversas fases são termodinamicamente estáveis Curvas de equilíbrio: Curvas que separam as regiões – indicam valores de Pressão e Temperatura em que duas fases estão em equilíbrio 08 Diagramas de fase TMA Forma compacta de exibir as mudanças de estado físicas que uma substância pode ter em função das variáveis temperatura e pressão Regra das fases: Fase (Phase) (P) Componentes (Components) (C) Grau de liberdade (degrees of Freedom) (F) PF C2 Fase: Quantidade de matéria que apresenta homogeneidade no que se refere à composição química e estado físico. Ex: fases sólida, líquida e vapor de uma substância pura, além das suas diferentes formas polimórficas Transição de fase: Conversão espontânea de uma fase em outra que ocorre em uma dada temperaturaa. 09 Temperatura de transição de fase: é a temperatura de equilíbrio entre fases. Corresponde a condição em que existe equilíbrio químico entre as fases TMA Diagrama esquemático Curvas de equilíbrio: Curvas que separam as regiões – indicam valores de Pressão e Temperatura em que duas fases estão em equilíbrio 10 TMA Pressão de vapor Substância pura em recipiente fechado Pressão de vapor: pressão do vapor em equilíbrio com o líquido Na condição de equilíbrio existe um equilíbrio entre evaporar e condensar. Existe um equilíbrio entre a taxa de evaporação e taxa de condensação T re 11 rc TMA Diagrama esquemático Descreve o comportamento de fusão – condição em que pressão de vapor=pressão externa Ponto Crítico Condição em que as três fases coexistem em equilíbrio 12 Mostra como a pressão de vapor na sublimação com a temperatura Mostra como a pressão de vapor do líquido varia com a temperatura TMA Ponto crítico Quando líquido é aquecido em um recipiente fechado: -a pressão de vapor e a densidade do vapor eleva com o aumento da temperatura -A densidade do líquido diminui ligeiramente pela expansão -Existe um ponto em que a densidade do líquido e do vapor são iguais e a interface líquido – gás desaparece. Este ponto é definido por uma temperatura dita Temperatura crítica e uma pressão dita Pressão crítica -Nestas temperaturas e pressões forma-se o fluido supercrítico 13 TMA 14 Ponto crítico Diagrama esquemático TMA PF C2 C =1 PF 3 P =1 F =2 P =1 F =2 P =1 F =2 P =3 F =0 15 P =2 F =1 TMA 16 Diagrama H2O TMA 17 Diagrama CO2 TMA 18 Diagrama He Diagrama Fe TMA 19 Diagrama Fe a P constante Diagrama Fe a P e T variável TMA Diagrama de equilíbrio - Termodinâmica No equilíbrio , o potencial químico de uma substância é constante numa amostra, qualquer que seja o número de fases presentes. Mesmo Potencial Químico Se μ 1 > μ2, ΔG é negativo, processo é espontáneo Se μ1 = μ2, ΔG é zero, processo em equilíbrio Se μ 1 > μ2, ΔG é positivo, processo não é espontáneo 20 TMA Diagrama de equilíbrio - Termodinâmica Temperaturas baixas – fase sólida tem potencial químico mais baixo e geralmente é a fase mais estável Temperaturas maiores – potenciais químicos alteram de forma diferenciada para cada fase. G m Sm T P T P 21 Estabilidade e pressão TMA Para pressões maiores a temperatura de fusão tende a aumentar O aumento da pressão resulta no aumento do potencial químico e este aumento é maior para gases, depois liquidos e depois sólidos (em geral). V(l) > V(s) Sólido 22 V(l) < V(s) Sólido TMA Construção das curvas de equilíbrio P, T P, T dG m VmdP SmdT d dG m VmdP SmdT no equilíbrio Variando T ou P para manterequilíbrio d d Vm, dP Sm,dT Vm, dP Sm,dT 23 V m, Vm, dP Sm, Sm, dT dP S dV V TMA Construção das curvas de equilíbrio S-L dP S dV V 24 Sólido Líquido TMA Construção das curvas de equilíbrio l - g dP S dV V 25 Líquido Gás TMA Construção das curvas de equilíbrio s -g Sublimação, considera que ΔvapH < ΔsubH, espera-se que a inclinação da curva de sublimação tenha inclinação menor. 26 Sólido Gás TMA Transformação de fase Transformações comuns Fusão Vaporização Transformações menos comuns Sólido-Sólido Semicondutor - Supercondutor Fluido - Superfluido Paul Ehrenfest – sugeriu um esquema de classificação para as transformações de fase, baseado em fatores termodinâmicos das substâncias. Várias transformações são acompanhadas de variações de entalpia e de volume. Estas mudanças podem afetar o potencial químico dos dois lados da transformação de fase. Genérico: Transformação de fase 27 α-β Transformação de fase TMA Vtrans e Htrans são diferentes de zero para a fusão e vaporização A inclinação da curva de potencial químico de cada lado da curva, contra pressão e temperatura, é diferente. Volume, V Potencial Temperatura 28 Entalpia, H ou S Isto é – existe descontínuidade na curva da primeira derivada de na transformação Temperatura Temperatura Uma transformação de primeira ordem é aquela que tem a primeira derivada do potencial químico em função da temperatura é descontínua. Transformação de fase TMA Volume, V Potencial Temperatura 29 Entalpia, H ou S Uma transformação de segunda ordemé aquela que tem a primeira derivada do potencial químico em função da temperatura contínua, entretanto a derivada segunda é descontínua. Temperatura Temperatura RELEMBRANDO - O Cp de uma substância é dado pela Inclinação da curva de entalpia em função da temperatura -Transformações de primeira ordem – Cp tende a infinito na transformação -Transformações de segunda ordem existe descontínuidade na curva Cp por temperatura Cp Cp Transformação de fase TMA Temperatura Primeira Ordem Temperatura Segunda Ordem Caso especial Transformações 30 TMA Transformação de fase – segunda ordem EXEMPLO: Mudança de simetria na estrutura cristalina em sólidos. Mudança de estrutura tetragonal para cubica – Em muitos casos esta mudança não envolve descontinuidade de energia ou volume, mostrando que não é uma transição de primeira ordem. 31 TMA Transformação de fase - Tranformação λ não é de primeira ordem Cp tende a infinito na transformação Cp tende a aumentar um pouco antes da transformação EXEMPLO – Transição ordem desordem em ligas – materiais ferromagnéticostransição no hélio líquido EXEMPLO – Transição ordem desordem em ligas CuZn. - Composições relevantes de 0 a 50% de Zn - Possíveis fases , , - Fase pode apresentar-se na forma (1)desordenada ( solução sólida, de estrutura CCC, onde os atomos de Cu e Zn se posicionam desordenadamente). Existe acima de 454-468º.C – possui baixa condutividade (2)Ordenada ( estrutura CCC com Cobre nos vértices e Zn no centro do cubo) – maior condutividade e boa dureza dificultando a conformação. 32 TMA Transformação de fase Transformação de fase envolvendo difusão Processo, em geral, depende do tempo Transformação de fase envolvendo deslocamento 33 Fase inicial tem mesma composição que fase resultante Processo, em geral, independe do tempo TMA Tensão superficial Liquidos costumam atingir configurações que minimizem a área superficial, ou seja: -Menor relação superfície/volume -Maior numero de moléculas (átomos) no volume interagindo com outras moléculas (átomos) Melhor configuração Entretanto outras forças podem agir no sentido contrário ao desta configuração. A força, ou melhor, o trabalho necessário para mudar a área superficial () é dada por dω γdσ 34 Se V e T são constantes onde é a tensão superficial dado em Jm-2 ou Nm-1 dA γdσ TMA 35 Superfícies curvas TMA 36 Bolhas, cavidades e gotas TMA 37 Capilaridade TMA 38 Ãngulo de Contato
Baixar