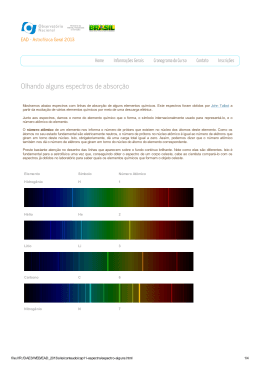
0. Espectros e os fantasmas da matéria Hd Hg Hb Ha Matéria Propriedades Luz Partículas Propriedades Propriedades 1. Introdução - Análise e Síntese • Qual nível de descrição é necessária? Praticidade – Schrödinger-Coulumb e , me , – Dirac-Maxwell relativística (EletroDinâmicaQüântica) a – CDQ (CromoDinâmicaQüântica) Lite LQCD – CDQ (para baixas energias)...mu , md – compreensão real, melhor que análise mais ultra-precisa possível ! – Esta é a linha histórica da FisAtoMole? Have not the small Particles of Bodies certain Powers, Virtues or Forces by which they act... upon on another for producing a great Part of the Phenomena of Nature? 31a Questão: “Principia” Isaac Newton ´atomoz matéria eletricidade Leukipp 440AC Faraday 1833 Demócrito 460-370AC Aristóteles 384-322AC Platão 427-347AC energia Planck 1900 N. von Autrecurt 1348 E S T R U T U R A química atômica D. Bernoulli 1700 - 1782 PROPORÇÕES J. Dalton 1766 - 844 J. L. Proust 1754 - 826 MOL MOVIMENTO A. von Humboldt 1769 - 859 A. Avogrado 1776 - 856 R. Brown 1773 - 853 L. Boltzmann 1844 - 906 J.L Gay-Lussac 1778 - 850 J. Loschmidt 1821 - 95 J.C. Maxwell 1831 - 79 R.J. Clausius 1822 - 88 Átomos - Conceitos e Ordens de Grandeza • constituição (#1) núcleo + nuvem eletrônica • propriedades estáticas – direta determinação pela quantização dos constituintes : • distribuição de cargas(#N- #e) núcleo (+#N|e|) & nuvem (-#e|e|). • momento angular orbital J . • momento angular intrinseco (spin sN e se) . • momento magnético. – determinação pela interação entre componentes : • massa átomo ~ mN + me ~ mN (energia de ligação e-ica << mN c2) • tamanho Vátomo ~ VN + Ve ~ Ve (alta densidade nuclear) • dinâmicas – troca de energia • Interação da distribuição de cargas com campos eletromagnéticos definido as propriedades de interação da luz com a matéria. • Interação com outras partículas, e, núcleos, partículas nucleares, etc... Núcleos - Conceitos e Ordens de Grandeza O Núcleo [prótons(Np) + neutrons (Nn)] • propriedades estáticas – direta determinação pela quantização dos constituintes : • distribuição isotrópica de cargas +Np|e|e +Nn|0|. • momento angular (spin sp e sn). • momento magnético. • massa mN >1mH até 200mH – m N < m p+ m n (energia de ligação nuclear ñ-desprezível) • tamanho rNuc ~ 10-5 rÁtomo – rp , rn O núcleo define a armadilha Coulumbiana dos elétrons. No caso do átomo de H é da ordem de : 1 e2 EH 5.1 1011 V ~ 100V m rH 40 rH !!! Elétrons - Conceitos e Ordens de Grandeza O Elétron [estrutura ?] • propriedades estáticas – direta determinação pela quantização dos constituintes : • distribuição isotrópica de cargas -|e|. • momento angular (spin se). • momento magnético, me. • massa me = 9,10956×10-31 kg • raio clássico re = 2.8×10-15 m • dinâmicas • velocidades relativísticas em torno do núcleo – vorbital ~ 0.01c m/me ~ 1.00005 • colisões com o núcleo 2a. Espectros: o fantasma atrás de cada átomo Hd Hg Hb Newton (1666): Espectro solar medido através de orifício & prisma Luz: onda (Huygens) ou partícula (Newton) Young & Fresnel (1800): ótica ondulatória Fraunhofer (1814): Espectro solar medido através de orifício & fenda Linhas escuras de Fraunhofer! Emissões ausentes no espectro contínuo? Ha 2b. Espectros: o fantasma atrás de cada átomo Hd Hg Hb Kirchhoff, Bunsen, Ångstrom Assinalaram várias linhas de Fraunhofer linhas observadas na emissão de elementos Ex: Kirchhoff (1859) duas destas linhas pertencem à emissão do Na em 590nm Fraunhofer: Fabrica grades de difração para aumentar resolução. Descoberta do He em 1868 na análise do espectro solar Ha 2c. Espectros: o fantasma atrás de cada átomo Hd Hg Hb Ha Série de Balmer (1885): n2 G , n 3,4 , 2 n 4 1 1 ou c 4c 2 2 G 2 n Huggins (1881) n = 60 350 n c 4 G RH espectro contínuo para 91,2 nm n’ = 2 sempre ? • Lyman (1906) n' 1 (UV) • Paschen (1908) n' 3 (IV) • Brackett (1922) n' 4 (IV) • Pfund (1924) n' 5 (IVD) Rydberg (1989) / Ritz (1898): termo espectral Tn RH c n2 determina transição entre n e n’ nn' Tn' Tn R H c 1 2 1 2 n' n 2d. Fantasmagórico? O problema do átomo de Rutheford Hd Hg Hb Como pode não irradiar sempre? Cargas em movimento não irradiam? Estados estacionários? Órbitas estacionárias? Ha 2.1.a O modelo de Bohr (1913)- com Planck em mente • Equilíbrio dinâmico de forças Fcentrífuga= FCoulumb e2 mr 4 0 r 2 2 •Conservação de energia E=K+V 1 1 K mv 2 I 2 , I mr 2 2 2 r e 2 dr' e2 V 2 4 0 r 4 0 r' A energia total deste sistema é: 1 e2 2 E r m r 2 4 0 r 2 1 e 1 2 4 0 r 1 e2 2 4 0 r ou, explicitando a freqüência angular: 1 e2 1 E 2 4 0 r 1 e 4 m 2 3 2 4 0 2 2.1.b O modelo de Bohr - com Planck em mente • Princípio de correspondência freqüência orbital clássica corresponde à oscilação dipolar e, à sua emissão em órbitas onde n: n1n Tn Tn1 1 1 RH c 2 n 12 n 2n 1 2 RH c RH c 2 2 n3 n n 1 n • Quantização dos níveis de energia En RH hc n2 1 1 2 4 m e2 RH 2 8 0 hc 0 1 2 3 2 3 4 2R c e m 2 H3 n 1 e2 1 a ~ 40 c 137 m c2 a 2 En 2 n2 2.1.c O modelo de Bohr - com Planck em mente • Níveis de energia 511keV En 2 11372 n2 13,59 eV 2 n • Quantizando todo o resto – raio da órbita 1 e2 En 2 40 rn 2 2 2 rn 40 n 52 , 9 n fm 2 me – velocidade / freqüência angular 1 1 K n mrn2 2n E n 2 2 n 1 40 2 – momento angular n mrn2 n n me 4 1 1016 3 Hz 3 3 n n vn a c n O mundo quântico é aqui ! • O primeiro passo da análise (o conceito atômico)
Baixar