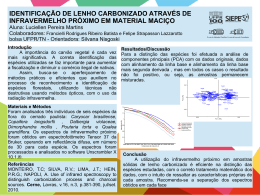
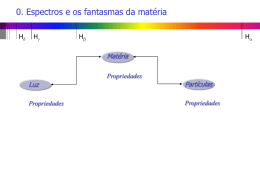
EAD - Astrofísica Geral 2013 Home Informações Gerais Cronograma do Curso Contato Inscrições Olhando alguns espectros de absorção Mostramos abaixo espectros com linhas de absorção de alguns elementos químicos. Este espectros foram obtidos por John Talbot a partir da excitação de vários elementos químicos por meio de uma descarga elétrica . Junto aos espectros, damos o nome do elemento químico que o forma, o símbolo internacionalmente usado para representá-lo, e o número atômico do elemento. O número atômico de um elemento nos informa o número de prótons que existem no núcleo dos átomos deste elemento. Como os átomos no seu estado fundamental são eletricamente neutros, o número de prótons no núcleo atômico é igual ao número de elétrons que giram em torno deste núcleo. Isto, obrigatoriamente, dá uma carga total igual a zero. Assim, podemos dizer que o número atômico também nos dá o número de elétrons que giram em torno do núcleo do átomo do elemento correspondente. Preste bastante atenção no desenho das linhas que aparecem sobre o fundo contínuo brilhante. Note como elas são diferentes. Isto é fundamental para a astrofísica uma vez que, conseguindo obter o espectro de um corpo celeste, cabe ao cientista compará-lo com os espectros já obtidos no laboratório para saber quais os elementos químicos que formam o objeto celeste. Elemento Símbolo Número Atômico Hidrogênio H 1 Hélio He 2 Litio Li 3 Carbono C 6 Nitrogênio N 7 file:///R:/DAE3/WEB/EAD_2013/site/conteudo/cap11-espectro/espectro-alguns.html 1/4 Nitrogênio N 7 Oxigênio O 8 Neônio Ne 10 Sódio Na 11 Magnésio Mg 12 Alumínio Al 13 Silício Si 14 Enxofre S 16 Argônio Ar 18 Cálcio Ca 20 file:///R:/DAE3/WEB/EAD_2013/site/conteudo/cap11-espectro/espectro-alguns.html 2/4 Ferro Fe 26 Criptônio Kr 36 Estrôncio Sr 38 Xenônio Xe 54 Bário Ba 56 Você deve estar estranhando estas imagens. Dissemos anteriormente que o espectro de emissão se caracteriza por linhas brilhantes sobre um fundo escuro enquanto que o espectro de absorção se apresenta como um conjunto de linhas escuras sobre um fundo contínuo colorido. No entanto, as imagens acima parecem ser uma mistura disso: nós vemos linhas brilhantes sobre um fundo contínuo colorido! O que estamos mostrando acima são espectros obtido por John Talbot a partir de um programa que lê um arquivo que contém uma lista de comprimentos de onda de linhas de emissão e as simula sobre um fundo contínuo. Podemos usar o trabalho de Talbot para visualizar os espectros de absorção ou emissão. Para você ver o espectro de linhas de absorção desses elementos químicos para cada um dos espectros apresentados, observe o fundo colorido, que é o espectro contínuo, e na posição de cada uma das linhas brilhantes que aparecem nele imagine uma linha preta. Este seria o espectro de absorção de cada um destes elementos químicos. Para ver o espectro de emissão basta você olhar para as imagens disponíveis acima e utilizar a lei de Kirchhoff que afirma que as linhas de emissão e de absorção de um determinado elemento químico são as mesmas. Para cada um dos espectros, elimine o fundo colorido, que é o espectro contínuo, e observe somente as linhas brilhantes que aparecem neles. Este seria o espectro de emissão de cada um destes elementos químicos. "Puxa, como é fácil fazer astrofísica! Eu quero uma moleza dessas!" Bem, na verdade eu estou contando apenas uma pequena parte da história. Ao obter o espectro de um corpo celeste, o que você vai ver não é algo tão bonito como o mostrado acima. Os espectros que obtemos das estrelas, por exemplo, sofrem diversas alterações físicas tais como o deslocamento das linhas, o seu alargamento, etc. Além disso, descobrir quais são os elementos presentes em um espectro não é tão trivial. Com exceção de algumas linhas muito conhecidas, identificar quais são os elementos representados por todas as outras linhas em um espectro exige do file:///R:/DAE3/WEB/EAD_2013/site/conteudo/cap11-espectro/espectro-alguns.html 3/4 linhas muito conhecidas, identificar quais são os elementos representados por todas as outras linhas em um espectro exige do astrônomo uma certa habilidade, embora existam programas profissionais de redução de dados, tais como o IRAF, que ajudam muito o pesquisador. Copyright © DAED | Observatório Nacional file:///R:/DAE3/WEB/EAD_2013/site/conteudo/cap11-espectro/espectro-alguns.html 4/4
Baixar