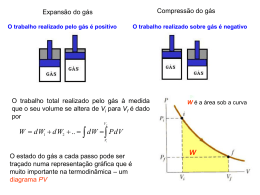
CALOR, TRABALHO E A 1ª. LEI DA TERMODINÂMICA Anotações baseadas no texto “Fundamentos da Termodinâmica de Sontagg, R. E. , Borgnakke, C. e Van Wylen, G. J. CALOR, TRABALHO E A 1ª. LEI DA TERMODINÂMICA Trabalho e calor são a essência da termodinâmica. Assim é fundamental o entendimento das duas definições tendo em vista que a análise correta de muitos problemas térmicos depende da distinção entre elas. Trabalho de um sistema Definição. Um sistema realiza trabalho se o único efeito sobre o meio (externo ao sistema) PUDER SER o levantamento de um peso. Trabalho atravessa a fronteira do sistema neste caso? Caso 1. Trabalho atravessa a fronteira do sistema nesse caso? Caso 1. Trabalho Mecânico. dW F x dx F .dx . cos F .dx 2 W F .dx 1 Se F constante , mov. retilíneo l2 2 W F .d l 1 F .dl l1 l2 W F dl Fl l1 dW F .d s W dW F .d s O trabalho de um sistema é considerado positivo quando é recebido pelo sistema e o trabalho realizado é negativo quando sai do sistema. O símbolo W designa o trabalho termodinâmico. Unidades de Trabalho 1 J = 1N.m Potência e unidades de potência. W W t Watt J s Trabalho Realizado devido ao Movimento de Fronteira de um Sistema Compressível Simples num Processo Quase-Estático. Vamos tirar um dos pequenos pesos do êmbolo provocando um movimento para cima deste, de uma distância dx. Podemos considerar este pequeno deslocamento de um processo quase-estático e calcular o trabalho, dW, realizado pelo sistema durante este processo. A força total sobre o êmbolo é P. A, onde P é a pressão do gás e A é a área do êmbolo. Portanto o trabalho W é: a) na compressão W > 0 dW p . A .n .d x p . A .dx . cos 180 p .dV W V2 pdV <0 V1 b) na expansão W < 0 dW p . A .n .d x p . A .dx . cos 0 p .dV W V2 pdV V1 >0 Correção da fórmula: V2 dW pdV Eq. 3.6. V1 Esse trabalho é o realizado devido ao movimento de fronteira de um sistema compressível simples num processo quase-estático. O trabalho realizado devido ao movimento de fronteira, durante um dado processo quase-estático, pode ser determinado pela integração da Eq. 3.6. Entretanto essa integração somente pode ser efetuada se conhecermos a relação entre P e V durante esse processo. Essa relação pode ser expressa na forma de uma equação ou pode ser mostrada na forma gráfica . Visualização do trabalho num processo quase-estático. W12 > 0 W21 < 0 No inicio do processo o êmbolo está na posição 1 e a pressão é relativamente baixa. Esse estado está representado no diagrama P x V como mostra a Figura5. No fim do processo, o êmbolo está na posição 2 e o estado correspondente do sistema é mostrado pelo ponto 2 no diagrama P x V. Se a compressão é um processo quase-estático e, durante o processo, o sistema passa através dos estados indicados pela linha que liga os pontos 1 e 2 do diagrama P x V. O trabalho realizado sobre o gás durante este processo de compressão pode ser determinado pela integração da Eq. 3.6, resultando: V2 W 12 pdV V1 Trabalho num processo quase-estático. Uma nova consideração do diagrama P x V, conduz a uma outra conclusão importante. É possível ir do estado 1 ao estado 2 por caminhos quase-estáticos muito diferentes, tais como A, B ou C. Como a área sob a curva representa o trabalho para cada processo é evidente que o trabalho envolvido em cada caso é uma função não somente dos estados iniciais e finais do processo, mas também, do caminho que se percorre ao ir de um estado a outro. Por esta razão, o trabalho é chamado de função de linha, ou em linguagem matemática, W é uma diferencial inexata, diferente das diferencias exatas que dependem apenas do estado inicial e final ,como veremos é o caso da energia cuja diferencia é indicada como dE. Trabalho processos quase-estáticos de transformação. 1-A relação entre P e V pode ser dada em termos de dados experimentais ou na forma gráfica. Neste caso podemos determinar a integral da Eq. 3.7 por integração gráfica ou numérica. 2-A relação entre P e V é tal que seja possível ajustar uma relação analítica entre as variáveis e, assim, é possível fazer diretamente a integração da expressão. Processo quase-estático a pressão constante (isobárico). p cte p 1 p 2 V2 V1 V1 V2 W pdV pdV p V 2 V 1 Trabalho processos quase-estáticos de transformação. Processo a temperatura constante (isotérmico) pV cte p 1V 1 p 2 V 2 V2 V1 W pdV V1 V2 cte V dV P1V 1 ln V 2 / V 1 Processo politrópico pV n n cte p1V1 p 2V 2 p cte V n n Processo politrópico V2 V1 W pdV cte V1 W W dV V n V2 cte n1 V 1 n 2 1 cte V n 1 1 n V1 n 1 V2 V1 p 2 V 2 p 1V 1 n n 1 n 1 n p V V p V V 2 2 2 1 1 1 n1 n1 1 Note-se que este resultado é válido para qualquer valor do expoente n, exceto n = 1. Para n = 1, tem-se; pV cte p1V1 p 2V 2 V2 W pdV cte V1 V1 dV V V2 V P 1V 1 * ln 2 V1 V P 2 V 2 * ln 2 V 1 Exemplo 3.1. Considere como sistema o gás contido no cilindro mostrado na figura 8, provido de um êmbolo sobre o qual são colocados vários pesos pequenos. A pressão inicial é de 200 kPa e o volume inicial do gás é de 0,04 m3. a) Calcular o trabalho realizado pelo sistema durante esse processo se for colocado um bico de Bunsen embaixo do cilindro e deixa-se que o volume do gás aumente para 0,1 m3 , enquanto a pressão permanece constante. V2 P cte W 12 p dV p V p V 2 V 1 - 200000 * (0,1 - 0,04) - 12,0 kJ V1 b) Considerando o mesmo sistema e as mesmas condições iniciais e finais, porém, ao mesmo tempo em que o bico de Bunsen está sob o cilindro e o êmbolo se levanta, removamos os pesos deste, de tal maneira que durante o processo a temperatura se mantém constante. Se como gás ideal: PV = mRgT V W P 1V 1 * ln 2 V1 0 ,1 200000 * 0 , 04 * ln 7,33 kJ 0 , 04 c) Consideremos o mesmo sistema porém, durante a troca de calor removamos os pesos de tal maneira que a expressão, PV1,3 = constante, descreva a relação entre a pressão e o volume durante o processo. Novamente o volume final é 0,1 m3. Calcular o trabalho envolvido. 1, 3 p 1V 1 p 2V 2 1, 3 0 , 04 P2= 200000 * 0 ,10 W p 2V 2 p 1V 1 n 1 200000 * 0 , 04 1, 3 p 2 0 ,1 1, 3 1,3 = 60,77 kPa 60773 * 0 ,1 200000 * 0 , 04 0,3 6,41 kJ d) Consideremos o sistema e o estado inicial dado nos três primeiros exemplos, porém mantenhamos o êmbolo preso por meio de um pino, de modo que o volume permaneça constante. Além disso, façamos com que o calor seja transferido do sistema para o meio até que a pressão caia a 100 kPa. Calcular o trabalho. Como dW = P.dV, para um processo quase-estático, o trabalho é igual a zero porque, neste caso, não há variação do volume, isto é, dV=0. Exemplo 3.2. Um cilindro com êmbolo móvel, como mostrado na figura, contém 3 kg d’água no estado de vapor úmido com título igual a 15 % e pressão de 2,0 bar (estado 1 ). Esse sistema é aquecido à pressão constante até se obter o título igual a 85 % (estado 2 ). Pede-se: a) Representar o processo em um diagrama P-V. b) Calcular o trabalho realizado pelo vapor durante o processo. Tsat= 120,2 oC b) O trabalho devido ao movimento de fronteira é: W 12 p .m .v 2 v 1 Da tabela de propriedades de saturação, para o estado 1, P = 200kPa obtemos vl = 0,001061 m3 /kg, vv= 0,8857 m3 /kg. v1 = vl + y ( vv-vl) = 0,001061 + 0,15 ( 0,8857 -0,001061) = 0,13376 m3 /kg. quando y =0,85 v1 = vl + y ( vv-vl) = 0,001061 + 0,85 ( 0,8857 -0,001061) = 0,7530 m3 /kg Substituindo na expressão do trabalho, Eq.3.07 tem-se: W12 = - 2,0.105 x 3 x (0,7530 -0,133756 ) J W12 = - 3,715.105 [ J ] ou W12 =- 371,5 kJ Exemplo 3.3 Um cilindro com êmbolo móvel, como mostrado na figura, contém 5 kg d’água no estado de vapor úmido com título igual a 20 % e pressão de 5,0 bar (estado 1). Esse sistema é aquecido à pressão constante até se obter a temperatura de 200 OC (estado 2). Pede-se: a) Representar o processo em um diagrama P-v; b) Determinar o trabalho realizado pela substância de trabalho contra o êmbolo, em kJ a) b) O trabalho devido ao movimento de fronteira é: Da tabela de propriedades de saturação, para o estado 1, P = 500 kPa obtem-se: vl1 = 0,001093 m3 /kg, vv1= 0,3749 m3 /kg. v1 = vl1 + x ( vv1-vl1) = 0,001093 + 0,2 ( 0,3749 -0,001093) = 0,0759 m3 /kg. Da tabela de vapor superaquecido para P2 = 500 kPa e T2 = 200 oC, obtem-se: v2 = 0,42492 m3 / kg. Assim o trabalho entre o estado 1 e 2 resulta em: W 12 p .m .v 2 v 1 W 12 5 . 10 * 5 * .0 , 42492 0 , 0759 5 = -872,7kJ. Trabalho contra uma mola Exemplo 3.4. Considere o sistema mostrado na Figura . O volume inicial do ar no interior do conjunto êmbolo-cilindro é de 0,03 m3, neste estado a pressão interna é de 1,1 kgf/cm2, suficiente para contrabalançar a pressão atmosférica externa e o peso do êmbolo. A mola toca o êmbolo mas não exerce qualquer força sobre o mesmo nesse estado. O sistema (ar) é então aquecido até que o volume do sistema seja o dobro do volume inicial. A pressão final do sistema é de 3,5 kgf/cm2 e, durante o processo a força de mola é proporcional ao deslocamento do êmbolo a partir da posição inicial [ F = k(x-xo)]. Pede-se: a) Considerando o ar como sistema, calcular o trabalho realizado pelo sistema b) Mostrar o processo em um diagrama, P - v Obs. 1 kgf/cm2 = 9,806 N *104 cm2/m2 = 98,06 kPa= 0,09806 MPa 2 a) sendo o trabalho W12 = pdV , e, sendo P = ( Patm + Pêmb + Pmola ), temos: 1 2 W Patm Pemb Pmola dV 1 k x xo mg P dV atm A A 1 2 kA x x o k V V o mg mg W Patm dV Patm dV 2 A AA A A 1 1 2 2 kV o kV ' k V V o W P dV p 2 dV 2 2 A A A 1 V1 V2 2 V2 kV p p2 p1 p 2 W p 2 dV 1 V V 2 V 1 A 2 2 V1 W 12 1 2 p1 p 2 V 2 V 1 1 2 1,1 3 , 5 0 , 09806 . 10 6 0 , 6 0 , 3 6 , 77 kJ Outras Formas de Realização de Trabalho. Trabalho de um eixo T F r F .r .sen 90 F .r n=> no de revoluções T F r tf w F .ds F . ds 2 . .r .n . F 0 w T . 2 .r .n 2 .n .T r w F . s F .v 2 .n .T Potencia de um eixo Exercício 3.5. Qual a potencia transmitida por um eixo de um automóvel quando o troque aplicado é 200 N .m e a sua rotação é 4000 rpm Sinal? Motor < 0 Turbina < 0 Bomba hidráulica > 0 Calor Calor é definido como sendo a forma de energia transferida através da fronteira de um sistema a uma dada temperatura, a um outro sistema (ou meio ) numa temperatura inferior, em virtude da diferença de temperatura entre os dois sistemas. Isto é, o calor é transferido do sistema de maior temperatura ao sistema de temperatura menor e a transferência de calor ocorre unicamente devido à diferença de temperatura entre os dois sistemas. Um outro aspecto dessa definição de calor é que um corpo ou sistema nunca contém calor. Calor só pode ser identificado quando atravessa a fronteira. Assim o calor é um fenômeno transitório. Comparação entre Calor e Trabalho Há muita semelhança entre calor e trabalho, que passaremos a resumir: a) O calor e o trabalho são, ambos, fenômenos "transitórios". Os sistemas nunca possuem calor ou trabalho, porém qualquer um deles ou, ambos, atravessam a fronteira do sistema, quando o sistema sofre uma mudança de estado. b) Tanto o calor como o trabalho são fenômenos de fronteira. Ambos são observados somente nas fronteiras do sistema, e ambos representam energia atravessando a fronteira do sistema. c) Tanto o calor como o trabalho são funções de linha e têm diferenciais inexatas. Convenção de sinais Calor e trabalho O que atravessa a fronteira? a) b) 3.6. Um condensador de grande porte (trocador de calor ) utilizado numa grande central de potencia deve transferir 100 MW da água que escoa num ciclo de potencia para a água de refrigeração (bombeada de um reservatório). Considerar que a parede dos tubos do trocador de calor que separa a água aquecida d’água de refrigeração tenha uma espessura de 4 mm e seja feita de aço cuja condutibilidade térmica nas condições de utilização seja 50 W/m.K. O projeto do trocador considera que a diferença de temperatura máxima entre os dois fluidos seja 5 oC. Admitindo que os coeficientes de transferência de calor (convectivos) sejam muito grandes determinar a área mínima de transferência do condensador 3.7. A área total de troca de calor de um condensador de uma geladeira domestica é 1 m2. O temperatura da superfície externa do condensador é 35 oC e o coeficiente médio de transferência de calor (convectivo) é 15 w/m2. K. Qual a quantidade de calor transferida para o ambiente durante 15 minutos de operação da geladeira.Considere a temperatura do ar igual a 20 oC. Primeira Lei da Termodinâmica A primeira lei da termodinâmica é comumente chamada de "lei da conservação da energia". Nos cursos elementares de física, o estudo da conservação de energia dá ênfase às transformações de energia cinética e potencial e suas relações com o trabalho. Uma forma mais geral de conservação de energia inclui os efeitos de transferência de calor e a variação de energia interna. Primeira Lei A energia não pode ser criada ou destruída . Só se pode mudá-la de uma forma para outra, ou só acrescentá-la a um sistema retirando de outro lugar (da vizinhança). Formas de Energia Energia Cinética. Energia que um objeto possui ao se movimentar com determinada velocidade ( macroscópica e dependentes de um referencial externo). Ek m V 2 ou 2 ek V 2 Unidades? 2 Energia Potencial. Energia que um objeto possui em função de sua altura quando está submetido a um campo gravitacional( macroscópica). E p mgh ou e p gh Unidades? Energia Interna. Energia relacionada à estrutura molecular e sua atividade molecular e não dependem de referencial externo( microscópica). U ou u Unidades? Energia Cinética. dv ds E k W F .ds m .a .ds m . ds dt ds W F .ds m Ek m ek dv ds V v .ds m v .dv 2 2 2 1 v 22 v 12 m 2 2 ou V 22 V 12 E k m 2 ou V 22 V 12 e k 2 2 2 V m .v 2 2 dv ds m ds . dt ds Energia Potencial. E p W F .ds mg .ds mg s h2 h1 mg h 2 h1 E p mg h ou e p g h Energia Interna. energia sensível Energia Interna. energia latente: arranjos molecular (sólido, líquido ou gasoso) Energias estáticas : armazenadas no sistema. Energias dinâmicas (interações de energia): identificadas na fronteira no sistema e representam a energia ganha ou perdida pelo sistema. O calor e o trabalho. Energias organizada :energia cinética macroscópica, energia potencial armazenadas no sistema, trabalho. Energias aleatória ou desorganizada organizada :energia cinética microscópica, calor. Energia de um sistema E Ek E p U E m v e ek e p u 2 m . g .h U 2 e v 2 g .h u 2 Trabalho e calor Calor e trabalho são fenômenos de fronteira. Ambos são observados somente nas fronteiras do sistema, e ambos representam energia atravessando a fronteira do sistema. Primeira Lei da Termodinâmica para um ciclo A primeira lei da termodinâmica estabelece que, durante um processo cíclico qualquer, percorrido por um sistema, a integral cíclica (somatório sobre todo o ciclo), do calor é proporcional à integral cíclica do trabalho, matematicamente ciclo Q ciclo W Q W Toda a experiência efetuada até agora provou a veracidade direta ou indiretamente da primeira lei. A primeira lei nunca foi contestada e tem sido satisfeita por muitas experiências físicas diferentes. Primeira Lei para Mudança de Estado de um Sistema Considere-se um sistema que percorre um ciclo, mudando do estado 1 ao estado 2 pelo processo A e voltando do estado 2 ao estado 1 pelo processo B. Este ciclo está mostrado na Figura. Da primeira lei da termodinâmica temos; Q W 2 1 1 Q A 2 2 Q B W A 1 1 2 W B Primeira Lei para Mudança de Estado de um Sistema Agora, consideremos outro ciclo, com o sistema mudando do estado 1 ao estado 2 pelo mesmo processo A e voltando ao estado 1 pelo processo C como indicado na Figura. Para este ciclo podemos escrever: 2 1 Q A 12 2 1 Q B W A W B 2 1 21 1 2 Q C W A Q A 1 2 1 W C 2 Subtraindo a segunda destas equações da primeira, temos, 1 1 Q B 2 1 1 Q C W B 2 2 W C 2 ou reorganizando os termos: 1 1 Q B 2 1 W B 2 1 Q 2 B 1 W B Q C 2 W C 2 1 Q 2 C W C Primeira Lei para Mudança de Estado de um Sistema Visto que B e C representam caminhos arbitrários entre os estados 1 e 2 concluímos que a quantidade ( Q + W) é a mesma para qualquer processo entre o estado 1 e o estado 2. Em conseqüência, ( Q + W) depende somente dos estados inicial e final não dependendo do caminho percorrido entre os dois estados a quantidade, ( Q + W ), é uma função de ponto, e portanto, é a diferencial exata de uma propriedade do sistema. Essa propriedade é a energia total do sistema e é representada pelo símbolo E. Assim podemos escrever Q+W=dE 2 E 2 E1 2 dE Q W Q 1 1 E Q 12 W 12 12 W 12 Sistema isolado E Q 12 W 12 E Ek Ep U 0 E 0 U 0 Sistema fechado a V cte. E Q 12 W 12 E E k E p U Q 12 Sistema fechado a p cte. E Q 12 U Q 12 E Q 12 W 12 Q 12 p V 2 V 1 E E k E p U Q 12 U Q 12 p V 2 V 1 U 2 pV 2 U 1 pV 1 H Q 12 Exemplo 3.8 Um sistema inicialmente em repouso sofre um processo no qual recebe uma quantidade de trabalho igual a 200 kJ. Durante o processo o sistema transfere para o meio ambiente uma quantidade de calor igual a 30 kJ. Ao final do processo o sistema tem velocidade de 60 m/s e uma elevação de 50 m. A massa do sistema é de 25 kg, e a aceleração gravitacional local é de 9,78 m/s2. Determine a variação de energia interna do sistema durante o processo, em kJ . Sistema: O sistema sob análise é um sistema fechado, constituído da massa de 25 kg 2. No estado final o sistema está em equilíbrio (velocidade uniforme). 1ª Lei: ΔE = Q12 + W12 ou Δ U +Δ EC +Δ EP = Q12 + W12 EC 1 2 m v 2 v1 2 2 1 25 * 60 2 2 0 2 45000 J EP mg h 2 h 1 25 * 9 , 78 * 50 0 12225 J U EC EP Q W 30 kJ 45 , 0 kJ 12 , 225 kJ 200 kJ 112 , 775 kJ Entradas 200 kJ (trabalho) 200 kJ Variações Internas 45,000 kJ (energia cinética) 12,225 kJ (energia potencial) 112,775 kJ (energia interna 170,000 kJ (variação total) Saídas 30 kJ (calor) 30 kJ Exemplo 3.8. Considere 5 kg de vapor de água contida no interior do conjunto cilindro pistão. O vapor sofre uma expansão do estado 1 onde P = 5,0 bar e T=240 oC para o estado 2 onde P=1,5 bar e T=200 oC. Durante o processo 80 kJ de calor são transferidos para o vapor. Uma hélice é colocada no interior do conjunto através de um eixo para homogeneizar o vapor, a qual transfere 18,5 kJ para o sistema. O conjunto cilindro pistão está em repouso. Determinar a quantidade de trabalho transferido para o pistão durante o processo de expansão. caracterização: 1-o vapor é o sistema termodinâmico fechado. 2-não há variação de energia cinética e potencial 1ª Lei: ΔE = Q12 + W12 ou Δ U +Δ EC +Δ EP = Q12 + W12 W12 = Whélice + Wpistão Wpistao = m(u2 -u1) – Q12 –WHélice 500 kPa T 200 240 250 u1 = 2707,6 kJ u 2654,4 u1 2731,2 200 oC T 100 150 200 u 2658,0 u2 2654,4 u2= 2656,2 kJ Substituindo os valores numéricos na expressão (2) tem-se: Wpistao = 5*(2656 2 -2707 6 )kJ . - 80 kJ-18,5 kJ = 257,0 – 80,0 – 18,5 = -365,5 kJ
Baixar