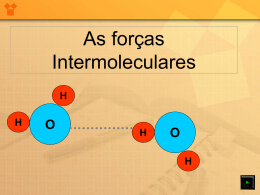
Propriedades Físicas dos Compostos Orgânicos - Forças Intermoleculares - Ponto de Fusão - Ponto de Ebulição - Polaridade - Solubilidade Polaridade A polaridade de uma molécula refere-se às concentrações de cargas da nuvem eletrônica em volta da molécula. É possível uma divisão em duas classes distintas: moléculas polares e apolares. Polaridade - Molécula Conceitos para Relembrar I: Molécula: é um conjunto eletricamente neutro de dois ou mais átomos unidos por pares de elétrons que se comportam como uma única partícula. Propriedades Físicas Polaridade – Molécula e Átomo Conceito para Relembrar II: Molécula: Quando iniciou-se o estudo e formulação da teoria atômica, era dado o nome de átomo a qualquer entidade química que poderia ser considerada fundamental e indivisível. As observações no comportamento dos gases levaram ao conceito de átomo como unidade básica da matéria e relacionada ao elemento químico, desta forma, houve uma distinção da molécula como "porção fundamental de todo composto", obtida pela união de vários átomos por ligações de natureza diferente. Conceitos para Relembrar III: Basicamente, o átomo abriga em seu núcleo partículas elementares de carga elétrica positiva (prótons) e neutra (nêutrons), este núcleo atômico é rodeado por uma nuvem de elétrons em movimento contínuo (eletrosfera). A maioria dos elementos não são estáveis, por isso, quando dois átomos se aproximam, há uma interação das núvens eletrônicas entre si. Esta interação se dá também com os núcleos dos respectivos átomos, isto acaba por torná-los estáveis. Os átomos se ligam e formam agregados de moléculas. Propriedades Físicas Polaridade Molécula polar - A soma Molécula apolar - A soma vetorial, dos vetores de polarização é diferente de zero. Moléculas polares possuem maior concentração de carga negativa numa parte da nuvem e maior concentração positiva noutro extremo. vetorial, dos vetores de polarização é nula. Nas moléculas apolares, a carga eletrônica está uniformemente distribuída, ou seja, não há concentração. Propriedades Físicas Polaridade A concentração de cargas (em moléculas polares) ocorre quando os elementos ligantes possuem uma diferença de eletronegatividade. Esta diferença significa que um dos átomos (o de maior eletronegatividade) atrai os elétrons da nuvem com maior força, o que faz concentrar neste a maior parte das cargas negativas. Toda ligação de dois átomos diferentes resulta em polarização, já que os átomos possuirão eletronegatividades diferentes. Exemplo: HCl, CaO, NaCl. Ligação de dois átomos iguais resulta em moléculas apolares. Ex: O2, N2, Cl2. Mas não é necessário serem dois átomos iguais para haver apolaridade, como por exemplo dos compostos alcanos. Propriedades Físicas Polaridade A distribuição espacial dos átomos que formam uma molécula depende das propriedades químicas e do tamanho destes. Quando muito eletronegativos os átomos formam ligações geralmente covalentes, pois apresentam aspecto equilibrado e simétrico. Se houver maior afinidade sobre os elétrons compartilhados, a distribuição espacial é deformada e modificam-se os ângulos da ligação, que passa a ser polar. No caso das substâncias iônicas, é nítida a diferença no que se refere à força de atração entre os elétrons, estes se deslocam de um átomo para outro. No caso do sal de cozinha, (cloreto de sódio - NaCl), no estado sólido, consiste de íons positivos de sódio e íons negativos de cloro. As forças elétricas existentes entre esses íons formam os seus cristais. Propriedades Físicas Polaridade - Eletronegatividade Conceitos para Relembrar IV: A Eletronegatividade é uma propriedade periódica que mede a tendência relativa de um átomo ou molécula em atrair elétrons, quando combinado em uma ligação química. Com sentido oposto à eletronegatividade usa-se o termo eletropositividade. Os valores da eletronegatividade são determinados quando os átomos estão combinados. Por isso, para os gases nobres, que em condições normais são inertes, não apresentam valor de eletronegatividade. Propriedades Físicas Polaridade – Eletronegatividade Conceitos para Relembrar V: A eletronegatividade de um átomo está intimamente relacionada com o seu raio atômico: Quanto menor o raio atômico, maior a atração que o núcleo do átomo exerce sobre o elétron que vai adquirir, portanto maior a sua eletronegatividade. Como conseqüência, esta propriedade tende a crescer na tabela periódica: Da esquerda para a direita e de e baixo para cima. Concluindo-se que o elemento mais eletronegativo da tabela é o flúor. Propriedades Físicas Polaridade Tabela de Eletronegatividade Propriedades Físicas Forças Intermoleculares Forças intermoleculares são as Forças intermoleculares forças que ocorrem entre uma têm origem eletrônica: molécula e a molécula vizinha. surgem de uma atração eletrostática entre nuvens Durante as mudanças de de elétrons e núcleos estado da matéria ocorre atômicos. somente um afastamento ou uma aproximação das São fracas, se comparadas moléculas, ou seja, forças às ligações covalentes ou moleculares são rompidas ou iônicas. formadas. Propriedades Físicas Forças Intermoleculares Força ou atração de Van der Waals Podem surgir de 3 fontes: 1. Dipolo-dipolo (ou Dipolo permanente - Dipolo permanente) 2. Dipolo-dipolo induzido (ou Dipolo induzido – Dipolo induzido) ou ainda Forças de dispersão ou Forças de London ** 3. Pontes de Hidrogênio ou Ligação de Hidrogênio ** reconhecida pelo físico polonês Fritz London Propriedades Físicas Força de Van der Walls Esta força é produzida pela correlação dos movimentos dos elétrons de um átomo com os movimentos dos elétrons de outro átomo tendendo a se aproximar para atingir a distância de energia mínima. Quanto maior o número de elétrons de que a molécula dispõe, mais polarizável será e portanto maior será a atração de Van der Waals. Propriedades Físicas “Lagartixa de Van der Walls” Lagartixa van der WaalsUma dúvida cruel tem atormentado muitos cientistas: como, de fato, a lagartixa consegue caminhar pelas paredes, mesmo no teto? Alguns sugeriram que suas patas possuissem microventosas. Entretanto, todas as tentativas de se provar a existência de tais ventosas falharam: as lagartixas possuem tal comportamento mesmo sob vácuo ou sobre uma superfície muito lisa e molhada. Em 1960, o alemão Uwe Hiller sugeriu que um tipo de força atrativa, entre as moléculas da parede e as moléculas da pata da lagartixa, fosse a responsável. Hiller sugeriu que estas forças fossem as forças intermoleculares de van der Waals. Tudo bem que elas mantenham moléculas unidas, mas... uma lagartixa? Poucos deram crédito à sugestão de Hiller. Até que, em um exemplar recente da revista Nature, Autumn escreveu o artigo "Full, Adhesive force of a single gecko foot-hair" (Autumn, K. et al., Nature 405, 681-685 (2000)), trazendo evidências de que, de fato, são forças intermoleculares as responsáveis pela adesão da pata da lagartixa à parede. Mais precisamente entre a superfície e as moléculas dos "setae", pelos microscópicos que cobrem as patas das lagartixas. Forças Intermoleculares 1. Dipolo- Dipolo São características de moléculas polares. As moléculas de alguns materiais, embora eletricamente neutras, podem possuir um dipolo elétrico permanente. Devido a alguma distorção na distribuição da carga elétrica, um lado da molécula e ligeiramente mais "positivo" e o outro é ligeiramente mais "negativo". A tendência é destas moléculas se alinharem, e interagirem umas com as outras, por atração eletrostática entre os dipolos opostos. Propriedades Físicas Forças Intermoleculares 1. Dipolo – Dipolo Em algumas moléculas o centro das cargas positivas não coincide com o centro das cargas negativas, mesmo na ausência de campos elétricos externos. Estas moléculas são chamadas polares, e possuem momento** de dipolo permanente. O Forças Intermoleculares CH 3 + 1.Dipolo – Dipolo H 3C + Note que o oxigênio é mais - O CH H 3C 3 + + - eletronegativo que o carbono. Isto torna a ligação C-O polar. As moléculas do éter representado ao lado não podem realizar ligações de hidrogênio porque falta o H deficiente em elétrons (mas possuem o par eletrônico não ligante disponível para a formação da ligação de hidrogênio). Propriedades Físicas Forças Intermoleculares 2. Dipolo – Dipolo Induzido Ocorre quando a molécula é apolar. A presença de moléculas que tem dipolos permanentes podem distorcer a distribuição de carga elétrica em outras moléculas vizinhas, mesmo as que não possuem dipolos (apolares), através de uma polarização induzida. Propriedades Físicas Forças Intermoleculares 2. Dipolo – Dipolo Induzido O momento de dipolo de um átomo ou molécula apolar num campo elétrico externo é chamado de Dipolo Induzido. Se o campo elétrico for não uniforme, haverá uma força elétrica resultante não nula atuando sobre o dipolo:Esta é a força responsável pela conhecida atração de pequeninos pedaços de papel por um pente carregado. Propriedades Físicas Forças Intermoleculares 2. Dipolo – Dipolo Induzido Normalmente hidrocarbonetos (substâncias formadas apenas por Hidrogênio e Carbono) são consideradas apolares: apesar do átomo de carbono ser mais eletronegativo que o átomo de hidrogênio, esta diferença de eletronegatividade não é significativa. Nesta situação (interação dipolo induzido-dipolo induzido) o que importa é a área superficial. Quanto maior for esta área, maior será a interação. CH CH 3 -CH 2 -CH 2 -CH 2 -CH CH 3 -C-CH 3 3 CH 3 -C-CH 3 CH CH 3 -CH 2 -CH 2 -CH 2 -CH CH 3 3 3 CH 3 3 Forças Intermoleculares 2. Dipolo – Dipolo Induzido Em um determinado instante, o centro de carga negativa dos elétrons e de carga positiva do núcleo atômico poderia não coincidir. Esta flutuação eletrônica poderia transformar as moléculas apolares, tal como o benzeno, em dipolos tempodependentes, mesmo que, após um certo intervalo de tempo, a polarização média seja zero. Estes dipolos instantâneos não podem orientar-se para um alinhamento de suas moléculas, mas eles podem induzir a polarização das moléculas adjacentes, resultando em forças atrativas. Propriedades Físicas Forças Intermoleculares 3. Pontes de Hidrogênio Quando um átomo de hidrogênio liga-se por covalência a um átomo mais eletronegativo mantém uma afinidade residual por outro átomo eletronegativo, apresentando uma tendência à carga positiva. Por exemplo, um átomo de hidrogênio (receptor de elétrons) pode atuar como uma ponte entre dois átomos de oxigênio (doador de elétrons), ligando-se a um deles por ligação covalente e ao outro por forças eletrostáticas. Propriedades Físicas Forças Intermoleculares 3. Pontes de Hidrogênio H O Ocorre quando existe um átomo de H deficiente em elétrons e um par eletrônico disponível (principalmente em grupos -OH e -NH ). H O O H H H O O H Propriedades Físicas H H H H Forças Intermoleculares 3. Pontes de Hidrogênio Ligação Hidrogênio: ocorre entre átomos de hidrogênio ligados a elementos como o oxigênio, flúor ou nitrogênio, com átomos de O, N ou F de outras moléculas. Esta interação é a mais intensa de todas as forças intermoleculares Propriedades Físicas Forças Intemoleculares 3. Pontes de Hidrogênio - Água Água A água, deve possuir um tipo de interação diferenciado. O que acontece é que os hidrogênios ligados ao oxigênio é que formam o lado "positivo" do dipolo permanente desta molécula. O átomo de hidrogênio é formado por apenas um próton e um elétron. Como o elétron é fortemente atraído pelo oxigênio, na água, este próton encontra-se desprotegido. A água possui, então, um dipolo bastante forte, com uma das cargas (positiva) bastante localizada. Este próton pode interagir com as regiões negativas (o oxigênio) de outras moléculas de água, resultando em uma forte rede de ligações intermoleculares. Propriedades Físicas Forças Intermoleculares 3. Pontes de Hidrogênio Como conseqüência das fortes interações intermoleculares, a água apresenta algumas propriedades especiais. Alguns insetos, por exemplo, podem andar sobre ela. Uma lâmina de barbear, se colocada horizontalmente, também flutua na água. Isto deve-se à tensão superficial da água. Propriedades Físicas 3. Pontes de Hidrogênio Conceitos para Relembrar V: Tensão Superficial da Água: uma propriedade que faz com o líquido se comporte como se tivesse uma membrana elástica em sua superfície. Este fenômeno pode ser observado em quase todos os líquidos, e é o responsável pela forma esférica de gotas ou bolhas do líquido. A razão é que as moléculas de água interagem muito mais fortemente com suas vizinhas do que com as moléculas do ar, na interface. As moléculas que estão no interior da gota, por exemplo, interagem com outras moléculas em todas as direções; as moléculas da superfície, por outro lado, interagem somente com moléculas que estão nas suas laterais ou logo abaixo. Este “desbalanço” de forças intermoleculares faz com que estas moléculas, da superfície, sejam atraídas para o interior do líquido. Para se remover estas moléculas da superfície é necessário uma certa quantidade mínima de energia - a tensão superficial. Para a água, isto corresponde a 0,07275 joules/m2, a 20oC. Líquidos orgânicos, como o benzeno ou o tolueno, tem valores menores de tensão superficial, já que suas interações intermoleculares são mais fracas. Propriedades Físicas 3. Pontes de Hidrogênio Tensão Superficial Propriedades Físicas Resumo Ligações Intermoleculares ou Ligações de Van der Waals, ou Forças de Van der Waals : I - atração dipolo induzido: dipolo induzido ou forças de dispersão de London II - atração dipolo permanente: dipolo permanente III - ponte de hidrogênio ou ligação de hidrogênio -> Substâncias apolares estabelecem somente ligações intermoleculares I. -> Substâncias polares sem ligações H - F, O - H e N - H estabelecem ligações intermoleculares I e II. -> Substâncias polares com ligações H - F, O - H e N - H estabelecem ligações intermoleculares I e III. Quanto maior for o tamanho da molécula, mais fortes serão as forças de dispersão de London. Propriedades Físicas Resumo Hierarquia das Forças Intermoleculares: Ponte de Hidrogênio é uma força > força dipolodipolo > força dipolo-dipolo induzido PH >> DD>> DDI Propriedades Físicas Resumo Os valores da eletronegatividade são determinados quando os átomos estão combinados. Por isso, para os gases nobres, que em condições normais são inertes, não apresentam valor de eletronegatividade. Ponto de Ebulição Quanto mais fortes forem as ligações intermoleculares, mais elevada será a temperatura de ebulição. Quanto mais “esférica” for a molécula, menor será seu ponto de ebulição, já que as forças de Van der Waals são mais eficientes quanto maior for a superfície de contato. Propriedades Físicas Ponto de Ebulição A água tem comportamento excepcional quando comparado aos pontos de ebulição de substâncias moleculares semelhantes. Podemos notar que, caso a água mantivesse a linearidade do gráfico, sendo essa linearidade ditada pela massa molecular dos compostos da mesma família, teria um ponto de ebulição próximo de 100 C!. Caso isso fosse verdade, a Terra não teria lagos, rios ou oceanos, e a água existiria na Terra somente no estado gasoso, mesmo nos pólos do Norte e Sul! Propriedades Físicas Ponto de Ebulição Ao contrário da água, o sulfeto de hidrogênio, bem como H2Se e o H2Te, são incapazes de formar ligações intermoleculares fortes. Ligações de hidrogênio, de forma apreciável, só são encontradas nas moléculas que contêm os elementos mais eletronegativos, como o flúor, o oxigênio e o nitrogênio. As propriedades das substancias com ligação H-X de polaridade elevada, semelhante à da água, como a amônia e o fluoreto de hidrogênio, são também influenciadas pelas ligações de hidrogênio, e muitas de suas propriedades, nos estados sólidos e líquidos, resultam das interações dipolodipolo entre suas moléculas. Propriedades Físicas Ponto de Fusão As substâncias iônicas tem P.F , P.E elevados e são geralmente sólidas porque os cátions e os ânions se atraem fortemente e a dificuldade de afastar os cátions e os ânions se traduz na dificuldade de fundir e de ferver as substâncias iônicas. Pelo contrário , as substâncias orgânicas são em geral covalentes e freqüentemente apolares; em conseqüência tem P.F e P.E. baixos e são geralmente líquidos ou gases. Propriedades Físicas Solubilidade A solubilidade é largamente afetada pela estrutura química dos compostos, sendo que o grau de solubilidade em água dos éteres glicólicos varia de acordo com o comprimento da cadeia do grupo alquila e o número de átomos de oxigênio presentes na molécula. Porém, isômeros podem apresentar diferenças. "O semelhante dissolve o semelhante.” Substância polar dissolve substância polar e não dissolve ou dissolve pouca quantidade de substância apolar. Substância apolar dissolve substância apolar e não dissolve ou dissolve pouca quantidade de substância polar. “Água – água/ solvente – solvente” Propriedades Físicas Solubilidade Um cubo de açúcar contém muitas moléculas e elas são mantidas unidas pelas pontes de hidrogênio (imagem a esquerda). Quando um cubo de açúcar dissolve, cada molécula permanece intacta. A molécula estabelece pontes com as moléculas de água e desfaz as pontes com as outras moléculas de açúcar. Por outro lado, o sal em solução transforma-se em íons (imagem a direita), como o cátion Na+ e o ânion Cl-. A solubilidade dessas substâncias só é possível devido a afinidade eletrônica existente entre o soluto (açúcar e o sal) e o solvente (a água). Solubilidade Existem basicamente dois meios de substância no que diz respeito a polaridade: polares e apolares. O termo "polar" nos dá a idéia de opostos, onde um dado ponto é negativo e o outro é positivo. Isso é resultado da diferença de contribuição na ligação entre elementos químicos diferentes. O mais eletronegativo atrai para perto de si o par de elétrons que estabelece a ligação com o outro átomo. Um exemplo de substância polar é água, considerada um solvente universal. Propriedades Físicas Solubilidade A água é um excelente solvente polar para compostos orgânicos polares de baixo peso molecular, como o metanol, etanol, ácido fórmico, ácido acético, dentre outros. Possuindo um dipolo bastante acentuado, atrai por eletrostática o dipolo da outra molécula, de forma a potencializar a solubilização. Porém, essas moléculas orgânicas possuem uma parte polar, solúvel em água e uma parte apolar, insolúvel em água. Propriedades Físicas Solubilidade A medida que aumenta-se o número de carbonos no grupo dos álcoois e ácidos carboxílicos por exemplo, a solubilidade, em meio aquoso vai diminuindo. É por isso que quando misturamos água com, por exemplo, butanol, constituído de 4 carbonos, a solubilidade em água diminui bastante, aparecendo claramente duas fases distintas indicando que as substâncias não são completamente miscíveis, mas sim parcialmente. Propriedades Físicas Solubilidade Vimos que a água é um ótimo solvente polar e, para compostos orgânicos polares de baixo peso molecular, também é um bom solvente. As ligações estabelecidas entre a água e o composto orgânico gera um fenômeno muito interessante, o qual pode ser realizado sem muitos equipamentos específicos de um laboratório. Podemos notar que tanto o etanol como o ácido propanóico possuem no mínimo uma ligação acentuadamente polar em suas moléculas, de forma a potencializar uma solubilidade em meio aquoso. No caso do álcool, a parte apolar não possui influência negativa na solubilidade em meio polar, já o ácido propanóico, com sua parte da molécula apolar, compromete a solubilidade total de composto em água. Mesmo assim, perceba que o número de pólos no ácido é maior do que no etanol. Propriedades Físicas Hidrocarbonetos Quanto maior o n.º de Carbonos maior o PM (peso molecular) , maior o PF (ponto de fusão) e PE (ponto de ebulição) ( maior a FVW ) Dois hidrocarbonetos de mesmo nº de C , quanto menos ramificada , maior a superfície de contato, maior a FVW, maior PF e PE. Não são polares, não são solúveis em água ( ou são pouco solúveis), são solúveis em solventes orgânicos. Hidrocarbonetos São menos denso que a água. PF e PE dos compostos cíclicos são maiores que dos não cíclicos. PE e PF dos alcenos são maiores que dos alcanos correspondentes. Álcoois Formam pontes de Hidrogênio entre si (tem - OH) Quanto maior o PM maior o PE ( maior a FVW). PE (álcool) > PE (Hidrocarboneto correspondente) ( devido às pontes de Hidrogênio ) Quanto maior o PM , menor a solubilidade em água (os primeiros álcoois são solúveis em água pois são polares e formam pontes de Hidrogênio c/ a água). Éter Não formam pontes de Hidrogênio entre si (só tem força dipolo-dipolo). ( R - O - R ) por isso tem baixo PE e PF. Quanto maior o PM, maior PE ( maior FVW) Muito pouco solúveis em água (devido à força dipolo) PE (álcool) > PE (éter) > PE (Hidrocarboneto de PM correspondente) ( pontes de H ) ( FVW ) Ácidos Carboxílicos ( - COOH ) são polares (tem FVW, força dipolo e pontes de H entre si e com a água) Os 4 primeiros ácidos são solúveis em água devido à polaridade e às pontes de H PE (ácidos) > PE (álcoois) > PE (aldeídos e cetonas) > PE (éter) > PE (Hidrocarboneto Correspondente) Aldeídos e Cetonas (C = O) são polares (força dipolo-dipolo) Aldeídos e Cetonas de baixo PM são solúveis em água (os outros são insolúveis) PE (álcoois) > PE (aldeídos e cetonas) > PE (Hidrocarboneto Correspondente) ( pontes de H ) ( força dipolo ) ( FVW ) Éster e Cloretos de Ácidos São compostos polares (força dipolo) Tem PE próximos ao correspondentes PE dos aldeídos e cetonas Amidas e Aminas São polares pois formam pontes de H ( entre o N e o H ) , são solúveis em água Densidade As substâncias Orgânicas são, em geral pouco densas (tem densidade menor que da água) por este motivo quando insolúveis em água essas substâncias formam uma camada que “flutua” sobre a água, como acontece com a gasolina, o éter comum , o benzeno, etc. Substâncias orgânicas contendo um ou mais átomos de massas atômicas elevadas podem ser mais densas que a água , exemplo CHBr3 é três vezes mais denso que a água.
Baixar