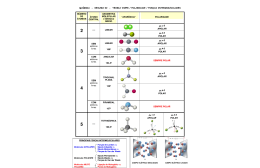
Andressa e Luanda As moléculas polares num campo elétrico sofrem ação de forças que tendem a alinha-las em direção ao campo, esse alinhamento é chamado de momento dipolo que é definido pela soma de forças vetoriais. As moléculas dotadas de um momento de dipolo se atraem de modo mais forte do que as que são desprovidas dele. Isto causa uma maior coesão, que se traduz por pontos de ebulição anormalmente elevados e por vezes fenômenos de insolubilidade. Se o momento de dipolo resultante da molécula for nulo, esta será apolar, se for não nulo, será polar. Moléculas diatômicas com eletronegatividade diferente são sempre polares. Ex: HF Moléculas com três ou mas átomos tem seu dipolo vetor resultante de acordo com a soma vetorial. A molécula CO2 embora tenha seus dois oxigênios com ligações polares, seu dipolo vetor resultante não será polar, pois a molécula é simétrica e por isso seus vetores se anularão. A água por causa da sua geometria triatômica angular terá seu vetor dipolo resultante apontado para cima, pois a soma dos seus vetores fazem com que a densidade dos seus elétrons se acumulem para o lado do oxigênio. Já o ozônio é polar devido ao fato da sua densidade eletrônica ser menor no seu átomo central O NH3 possui uma estrutura piramidal fazendo com que seu vetor resultante aponte para o N. Já o BF3 possui uma estrutura triangular plana, por isso seus vetores se anularão. Moléculas como o tetracloreto de carbono, CCl4, e o metano, CH4, são apolares devido às suas estruturas simétricas e tetraédricas. Moléculas tetraédricas com átomos de CL e H são polares. A eletronegatividade para os átomos de H é menor que a dos átomos de Cl, e a distância carbono-hidrogênio é diferente da distância carbono-cloro.
Baixar