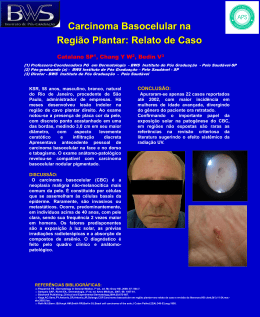
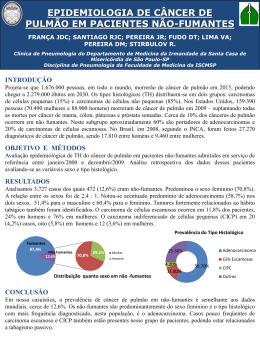
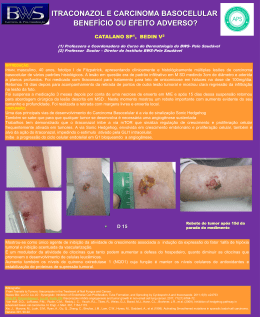
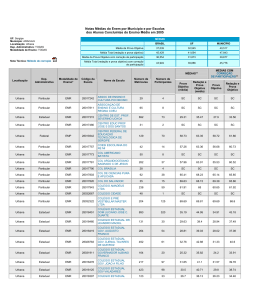
CÂNCER GÁSTRICO PRECOCE T. sano, A. Hollowood. Scandinavian Journal of Surgery 95: 249–255, 2006 Câncer gástrico precoce • Definido como o ADNCA confinado à mucosa ou submucosa, sem envolvimento linfonodal • Em paises com alta prevalência (Japão/Coréia), o tratamento tem mudado da cirurgia radical para outras técnicas, para melhor qualidade de vida Que cuidado se deve ter? • Possibilidade de subestimar o potencial de malignidade e perder a chance de cura com a cirurgia radical. Qual é a incidência? • Varia consideravelmente de região para região • Cerca de 56% dos casos novos ocorrem na asia e leste • Só no Japão o número de casos novos é maior que a soma dos casos das américas do norte, central e do sul Qual a incidência? • Representam 50% dos casos de cânceres gástricos tratados no Japão, e 40% dos tratados na Coréia • Acometem pacientes mais jovens que os cânceres avançados Qual a história natural • Tsukuma et al acompanharam 56 pacientes com CGP, e que não foram operados – A maioria evoluiu para CA avançado com uma média de 44 meses – Concluiram que é na maioria dos casos fatal, contudo com história natural prolongada História natural • A seqüência de lesão pré-neoplásica, para câncer gástrico precoce e depois para avançado pode levar anos, até o desfecho fatal • Isto sugere que pode haver subtipos, e, pacientes idosos, podem morrer de outras doenças, antes de morrer do câncer Há maneira de se distinguir estes sub-tipos? • Não, até os dias atuais Quais os principais tipos e características? • Os do tipo intestinal são mais distais no estômago, e atingem principalmente os mais velhos – Evoluem da gastrite atrófica para câncer – São mais influenciados por fatores ambientais • Os do tipo difuso têm uma incidência constante no mundo, e atingem principalmente mais jovens – Maior predisposição genética Quanto à evolução? • O tipo difuso cresce mais rapidamente e não permanece muito tempo como precoce, e podem se tornar menos diferenciados à medida que progridem Classificação macroscópica • Borrmann • I (elevado); II (ulcerado), III (ulcerado/infiltrante), IV (infiltrante) • Classificação Japonesa • I (protuso ou polipoide) • II (superficial) – IIa (elevado) – IIb (plano) – IIc (deprimido) • III (escavado) • A maioria possui área IIc isoladamente ou associada Classificação microscópica • Segundo Lauren 1965: • Intestinal – Células neoplásicas que forma estruturas tubulares bem definidas • Difuso – Células individuais infiltrando a parede gástrica, sem estrutura glandular Classificação microscópica • Classificação Japonesa: • Diferenciados – Adenocarcinoma papilar bem ou moderadamente diferenciado • Indiferenciados – Adenocarcinoma pouco diferenciado – Carcinoma com células em anel de sinete – Carcinoma mucinoso Classificação de Viena • Em função da discrepância entre os patologistas japoneses e ocidentais – Displasia de alto grau X Carcinoma • A partir de 1999: – Displasia de alto grau não invasiva – Carcinoma invasivo Sobre rastreamento • Rastreamento em massa só em áreas de grande incidência • Reed de duplo contraste (menos sensível) • Endoscopia (Mais sensível) • Dosagem de pepsinogênio sérico (detecção de atrofia) – Triagem de quem vai para EDA Sobre rastreamento • Combinação anti-corpo anti-H. pylori + pepsinogênio – Maior valor preditivo para CA gástrico Watabe et al Sintomas de DUP • Muitos simulam DUP • Áreas de CGP podem cicatrizar, espontaneamente ou com medicação – O uso de cimetidina ou IBP pode mascarar os sintomas – Recomendável EDA após alivio dos sintomas com a medicação CGP Multifocal • Representam entre 5 e 15% • Lesões sincrônicas são muito mais freqüentes que nos casos de doença avançada • Risco de desenvolvimento de câncer em outras áreas • Examinar bem as lesões menos relevantes • Deixar a lesão mais importante por último Metástases linfonodais • A única via de disseminação • Lesões com muito baixo risco de infiltração linfática podem ser tratados por mucosectomia • A profundidade é o mais importante – Mucosa 3% – Submucosa – até 20% • A maioria N1 • Até 5% N2 Metástases linfonodais • Outros fatores importantes: – Tamanho da lesão – Lesões indiferenciadas – Permeabilidade linfovascular • Fundamental: – A avaliação final só pode ser feita após exame de toda a peça por ressecção endoscópica submucosa Recentes estudos • Imunohistoquímica para detecção de células neoplásicas em linfáticos – Ainda em estudos Sobre o tratamento - EMR EMR • Descrita inicialmente por Tada et al, em 1984, só para diagnóstico • Não deve ser considerada tratamento final até o exame da peça • Condição para ser terapêutica: – Ressecção completa, margens livres, com muito baixa possibilidade de invasão linfonodal EMR • Condições para ser considerada curativa: – Lesões < 2 cm – Bem diferenciadas – Sem úlceras ou cicatrizes EMR • Novos critérios: > número de indicações – Carcinoma do tipo intestinal, de qualquer tamanho sem úlcera ou cicatrizes, podem ser curados – Carcinoma do tipo intestinal, menor que 1 cm, com úlcera ou cicatrizes, podem ser curados • O seguimento endoscópico é obrigatório (anual) – Lesões sincrônicas ou metacrônicas (podem também ser tratadas por EMR) EMR • Lesões metacrônicas em 8,2% – Tempo 3,1 anos após EMR – Na mesma região em 40,4% – A maioria tratada também com EMR Nakajina et al Gastrectomias • Tratamento padrão: – Hemigastrectomia – Gastrectomia total Gastrectomias modificadas • MG – A – Limitado à mucosa e submucosa – < 1,5 cm – Diferenciados • Inclui ressecção de gânglios perigástricos e ao longo da artéria gástrica esquerda Gastrectomias modificadas • MG – B – Lesões submucosas – < 2 cm – Estágio N1 • Inclui ressecção de gânglios celíacos e da artéria hepática • Se N1 > 2 cm ou N2 – Gastrectomias standard Gastrectomias • Na gastrectomia proximal para cânceres altos – Metastases para o hilo esplênico são raras (preservar o baço) – Interpor 15 cm de jejuno – Preservar o vago • Omentectomia – Sem evidências Gastrectomia com preservação do piloro para lesões do corpo Não dissecar os linfonodos supra-pilóricos Gastrectomia laparoscópica • Iniciada por Kitano et al 1994 – Segura – Menos dor – Menos hospitalização – Rápida recuperação – Melhor cosmética • Curva de aprendizado? Recorrência • Nos linfonodos negativos < 1% • Nos linfonodos positivos entre 7 e 17% – Observação: mesmo nos linfonodos positivos o prognóstico é bom se a lesão está limitada à mucosa • Metástases: – – – – Linfonodos Fígado Peritoneal Medula óssea Seguimento • EDA cada 2 ou 3 anos • CT ou US bianual • Fosfatase alcalina (metastase óssea) Conclusões • É uma doença curável • Há várias propostas de tratamento • A metástase linfonodal é o principal fator prognóstico – Planejamento de tratamento – Planejamento de seguimento • A profundidade é o que mais indica lesão linfonodal • O tamanho e o tipo histológico também são importantes FIM
Baixar