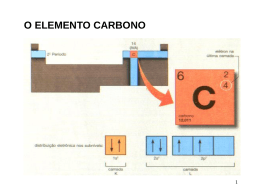
Orbitais atômicos, ligações sigma () e pi (), hibridização de orbitais Prof. Emiliano Chemello – www.quimica.net/emiliano Distribuição eletrônica Tarefa: faça a distribuição eletrônica dos elementos abaixo, no seu estado fundamental. a) 1H b) 7N c) 8O d) 17Cl 2 2 elétrons com spins opostos nível São encontrados com em uma região de probabilidade denominada orbital Um ou mais orbitais formam um Um ou mais subníveis formam um subnível 3 Representação esquemática de um orbital Representação esquemática de um par de elétrons com spins opostos Subnível s (1 orbital = 2 elétrons) Subnível p (3 orbitais = 6 elétrons) Subnível d (5 orbitais = 10 elétrons) Subnível f (7 orbitais = 14 elétrons) 4 O hidrogênio faz uma ligação, pois possui 1 orbital semi-preenchido 1H 1s1 7N 1s2 2s2 O nitrogênio faz três ligações, pois possui 3 orbitais semi-preenchidos 2p3 Tarefa: fazer a representação esquemática do oxigênio e deduzir quantas ligações ele necessita fazer. 5 8O 1s2 2s2 2p4 O oxigênio faz duas ligações, pois possui 2 orbitais semi-preenchidos 6 17Cl 1s1 3s2 2s2 2p6 3p5 O cloro faz uma ligação, pois possui 1 orbital semi-preenchido 7 Conclusão: O número de orbitais semi-preenchidos corresponde ao número de ligações químicas que o elemento precisa fazer com os demais elementos. 8 Química Quântica http://web.ccead.pucrio.br/condigital/video/e%20tempo%20de%20quimica/estruturaAtomica/quimicaQuanti ca/video%20para%20web/video.html 9 Princípio da incerteza de Heisenberg: “É impossível determinar simultaneamente a posição e a velocidade de um elétron num dado instante”. Em outras palavras, um elétron é caracterizado não pela sua posição ou pela sua velocidade, mas, sim, pela sua energia. Orbital é a região do espaço ao redor do núcleo onde a probabilidade de se encontrar um elétron é alta. 10 Formato do subnível ‘s’ (esférico) y x z 11 Formato do subnível ‘p’ (halteres) y x z 12 Tipos de interação entre orbitais em ligações covalentes: (sigma): ocorre quando há interação frontal de orbitais (pi): ocorre quando há interação em paralelo de orbitais Exemplo: H2 H H 1 ligação (s-s) 14 Exemplo: HCl H Cl 1 ligação (s-p) 15 Exemplo: Cl2 Cl Cl 1 ligação (p-p) 16 Exemplo: O2 O O 1 ligação (p-p) 1 ligação (p-p) 17 Exemplo: N2 N N 1 ligação (p-p) 2 ligações (p-p) 18 Exemplo: H2O H H O 2 ligações (s-p) 19 Resumindo Tipo de ligação entre átomos Simples X Y Dupla X =Y Tripla X Y Classificação 1 ligação 1 ligação 1 ligação 1 ligação 2 ligação 20 Exercício Determine o tipo de ligação ( ou ) e quais os orbitais envolvidos (s-s, s-p, p-p) nas substâncias abaixo: a) NH3 b) Br2 c) PH3 e) HI f) H2O2 g) N2H4 d) PCl3 21 LIVRO, 4A, aula 8: hibridação de orbitais 6C 1s2 2s2 2p2 Pela teoria dos orbitais semi-preenchidos, o carbono faria só duas ligações. Porém, experimentalmente sabe-se que o carbono faz quatro ligações. Como explicar? Hibridação de orbitais! sp³, sp² e sp 22 http://www.quimica.net/emiliano/hibridizacao.html 23 Hibridização sp3 Ex: a) Metano – CH4 4 ligações sp³s () 24 Hibridização sp3 Ex: b) Etano – C2H6 6 ligações sp³ s () 1 ligação sp³sp³ () 25 http://www.quimica.net/emiliano/hibridizacao.html 26 Hibridização sp2 Ex: Eteno – C2H4 4 ligações sp2 s () 1 ligação sp2sp2 () 1 ligação pp () -------------------------5 ligações 1 ligação 27 http://www.quimica.net/emiliano/hibridizacao.html 28 Hibridização sp Ex: Etino – C2H2 2 ligações sps () 1 ligação spsp () 2 ligação pp () -------------------------3 ligações 2 ligação 29 Resumindo Tipo de Ângulo entre Geometria Hibridização as ligações molecular sp3 Tetraédrica 109 28’ sp2 Trigonal plana 120 sp Linear 180 Tipos de ligação 4 3e1 2 e 2 30
Baixar