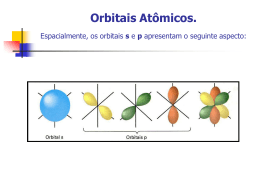
Capítulo 9: GEOMETRIA MOLECULAR E TEORIAS DE LIGAÇÃO Prof. Dr. Élcio Rogério Barrak Alunos: Natália Rodrigues Costa, 14305 EAM Saulo de Assis Maia, 14309 EAM Importância da Geometria Molecular Analgésico Narcótico Anti-tussígeno 9.1. Formas Espaciais Moleculares CCl4 α = 109,5° Comp. Lig. = 1,78 Å A forma espacial de uma molécula é determinada por: • Seus ângulos de ligação; • Comprimentos de ligação. Configurações Básicas ABn 9.2. Modelo RPENV (Repulsão do Par de Elétrons do Nível de Valência) • Um par ligante define uma região no espaço: domínio de elétron; • Um par não-ligante define também um domínio de elétron; • Ligações múltiplas definem um único domínio de elétrons. Determinando a Geometria Molecular .. NH3 H ― N ―H │ H (piramidal trigonal) Influência dos Pares Não-Ligantes no Ângulo de Ligação Ligações múltiplas têm o mesmo comportamento: aumento de domínio de elétrons → diminuição dos ângulos Moléculas com Nível de Valência Expandidos Átomo central do 3.º período em diante → mais de 8 elétrons ao seu redor. Formas Espaciais de Moléculas Maiores 9.3. Forma Espacial Molecular e Polaridade Molecular • Polaridade da ligação: Medida de como os elétrons são compartilhados em certa ligação; • Momento dipolar: Quantifica a separação das cargas na molécula. O momento de dipolo depende de: – Polaridade das ligações individuais; – Geometria das Moléculas. • Dipolo de Ligação: Momento dipolar relativo entre dois átomos da ligação. O momento de dipolo é uma grandeza vetorial, por isso possui módulo, direção e sentido. 9.4. Ligação Covalente e Superposição de Orbitais Ligação covalente → compartilhamento de elétrons • Há concentração de densidade entre os núcleos; • É o mesmo que ocorre quando um orbital atômico de valência se funde a outro → SUPERPOSIÇÃO DE ORBITAIS • Elétrons de spins contrários compartilhando mesmo espaço = ligação covalente H – 1s1 F – 1s2 2s2 2p5 Há uma distância ideal entre os núcleos unidos em ligação covalente. • Distância entre os átomos diminui → Aumenta a superposição → Aumenta a densidade → Diminui a energia potencial → Aumenta a força de ligação O ponto mínimo da curva indica o balanceamento entre forças de atração e repulsão 9.5. Orbitais Híbridos Suposição de que orbitais atômicos se misturam para formar orbitais híbridos. • 1. Mistura de pelo menos 2 orbitais atômicos não equivalentes (ex.: s e p). Os orbitais híbridos têm formas muito distintas dos orbitais originais. • 2. O número de orbitais híbridos é igual ao número de orbitais atômicos puros utilizados no processo de hibridação. • 3. As ligações covalentes são formadas por: a) Sobreposição de orbitais híbridos com orbitais atômicos. b) Sobreposição de orbitais híbridos com outros orbitais híbridos. De acordo como os átomos se aproximam, variam as posições dos orbitais híbridos. Esse processo denomina-se HIBRIDIZAÇÃO. Orbitais Híbridos sp Ex.: BeF2 Orbitais Híbridos sp2 e sp3 Ex.: BF3 Ex.: CH4 Orbitais híbridos envolvendo orbitais d seguem o mesmo padrão. 9.6. Ligações Múltiplas Ligação σ (Sigma): Ligação π (Pi): (menor superposição → menor força de ligação) Ligação Dupla: Obs.: Ligações π necessitam de que as partes da molécula sejam planares, por isso dão certa rigidez à molécula. (H2C ═ CH2) Ligação Tripla: Obs.: O livro “Química: a ciência central” trata somente (HC ≡ CH) de ligações π com orbitais p, apesar de ser possível com orbitais d. Ligações π delocalizadas Ocorre em moléculas com duas ou mais estruturas de ressonância envolvendo ligações π. Ex.: C6H6 (benzeno) (Ligações σ) (Orbitais 2p) (Ligações π delocalizadas) 9.7. Orbitais Moleculares • Pode acomodar no máximo dois elétrons (spins contrários); • Têm energia definida; • Podemos visualizar sua distribuição de densidade eletrônica. Ex.: H2 • • • • • σ → OM ligante (baixa energia) Mais estável; Forma de “salsicha”; Ligação covalente (maior densidade no eixo internuclear). σ* → OM anti-ligante (alta energia) Menos estável; Maiores densidades nos lados opostos dos núcleos. Diagrama de níveis de energia: (σ*) (σ) Átomo H Átomo H Molécula H2 Ordem de ligação A ordem de ligação determina a estabilidade de uma ligação covalente. Ordem de Ligação = ½ (n.º de e- ligantes – n.º de e- anti-ligantes) Resultados: 1 → ligação simples; 2 → ligação dupla; 3 → ligação tripla. Ordem de ligação = ½ (2 – 2) =½.0 =0 Ex.: He2 Resultados iguais a zero significam que a ligação não é possível. Átomo de He Átomo de He He2 NÃO EXISTE! Molécula de He2 9.8. Moléculas Diatômicas do Segundo Período Para moléculas homonucleares de valências s e p valem: • O número de orbitais moleculares formados é igual ao número de orbitais atômicos combinados; • Os orbitais atômicos se combinam mais efetivamente a outros de energias similares; • A eficiência com a qual dois orbitais atômicos se combinam é proporcional à superposição entre eles; • Cada OM pode acomodar dois elétrons com spins desemparelhados; • Quando OMs de mesma energia são ocupados, um elétron entra em cada orbital antes de ocorrer um emparelhamento. Orbitais moleculares para: • • Li2→ 1s2 2s1 1s e 2s: diferentes energias; 1s formam orbitais ligante σ1s e antiligante σ*1s 2s: mais distantes do núcleo / maior superposição / maior separação de energia; 1s: mais baixos em energia que 2s. ½ (4 – 2) = 1 (ligação simples) Obs.: os elétrons do cerne [Ne] não interferem na ligação. Be2 → 1s2 2s2 Segue mesmas regras de Li2, mas com oito elétrons dos OMs, logo: ½ (4 – 4) = 0 (não existe ligação) Diagrama para Li2: a ligação tem seis elétrons nos OMs. Orbitais moleculares a partir de orbitais atômicos 2p 2pz: orientação frontal - Densidade concentrada entre os núcleos → OM ligante → σ2p - Densidade excluída → OM antiligante → σ*2p 2px/2py: orientação lateral - Densidade concentrada em lados opostos da linha nuclear → OM π : π2p / π*2p Obs.: OM σ2p → mais estável que OM π2p OM σ*2p → menos estável que OM π*2p Configurações eletrônicas de B2 até Ne2 – valência 2s 2p • Os orbitais atômicos 2s têm menor energia que os orbitais atômicos 2p; • A superposição de dois orbitais 2pz é maior que as dos dois orbitais 2px e 2py; • Ambos os orbitais moleculares π2p e π*2p são duplamente degenerados. Há interação entre orbitais 2s-2p que afetam as energias de σ2s (caem) e σ2p (sobem). Essa alteração altera a ordem energética dos OMs: - B2, C2, N2 → OM σ2p > OM π2p - O2, F2, Ne2 → OM σ2p < OM π2p Configurações eletrônicas e propriedades moleculares O modo como uma substância se comporta sob a ação de um campo magnético permite a compreensão de sua distribuição eletrônica: • Há paramagnetismo quando existem elétrons desemparelhados, pois há maior força de atração; • Há diamagnetismo quando não há elétrons desemparelhados. Se há aumento da ordem de ligação, as distâncias de ligação diminuem e as entalpias aumentam, porém, moléculas com mesma ordem de ligação têm características diferentes. Ex.: O2 .. .. - ligação curta: 1,21 Å O.. = O .. - entalpia alta: 495 kJ/mol - é paramagnético: há dois elétrons desemparelhados - ordem de ligação: ½ (8 – 4) = 2 (dupla ligação) Moléculas diatômicas heteronucleares Ex: Óxido de Nitrogênio – NO . .. N .. = O.. –1 .. +1 . N.. = O .. Tem 11 elétrons de valência e é altamente reativo. As estruturas indicam ligação dupla, mas o pequeno comprimento de ligação indica ordem maior que dois. Se os átomos não diferenciam-se tanto em eletronegatividade, seus OMs serão parecidos com os das moléculas diatômicas homonucleares. ½ (8-3) = ½ 5 = 5/2 = 2 ½ Obs: a ordem de ligação indica mais do que dupla ligação, mostrando que pode haver falha em relação ao modelo de Lewis. A química da visão A retina possui células fotorreceptoras e uma parte delas possui um tipo de molécula chamada rodopsina, que é constituída de uma proteína, a opsina, e um pigmento violeta-avermelhado, o retinal. As variações nas ligações duplas do retinal iniciam reações químicas que resultam na visão. A rotação ocorre normalmente nas ligações simples, mas, para acontecer na duplas (π), precisa-se de energia. A luz é absorvida pela rodopsina e a energia é usada para quebrar a porção π da ligação dupla, permitindo a rotação. A reversão do retinal à sua forma original acontece de forma lenta, o que causa a cegueira temporária. Corantes Orgânicos A cor é relativa à absorção seletiva da luz: os elétrons passam de um OM para outro → se o comprimento de onda (λ) estiver na área visível do espectro, a substância aparecerá colorida. Pode-se observar dois orbitais em particular: HOMO (OM ocupado mais alto – maior energia) e LUMO (OM desocupado mais baixo – menor energia). A diferença de energia HOMO-LUMO é a mínima necessária para excitar o elétron. Se essa lacuna é grande, a substância é branca ou incolor. Os corantes orgânicos, moléculas que absorvem certos λ visíveis, são utilizados em filmes fotográficos e também no CD-R. Nesse disco compacto, o corante é fixado entre a película refletora e o polímero. O laser, ao atingir o corante, grava os dados, absorvendo específicos comprimentos de luz, num processo não reversível. Outro exemplo de corante é o β-caroteno, que absorve luz dentro do campo visível (500 nm) – é recebido pelo organismo, transformado em Vitamina-A, depois em retinal, que dá origem à rodopsina, componente da retina que permite percepção da luz. Referências Bibliográficas • “Química: A Ciência Central”. Lemay, Brown, Bursten. São Paulo: Pearson, 2005. (9.ª ed.) • “Química: Um Curso Universitário”. Mahan, Myers. São Paulo: Edgard Blücher, 1995. (4.ª ed.) • “Princípios de Química”. Masterton, Slowinski, Stanitski. Rio de Janeiro: Livros Técnicos e Científicos Editora S.A., 1990. (6.ª ed.) • http://labinfo.cefetrs.edu.br • http://www.dq.fct.unl.pt • http://dequi.faenquil.br
Download