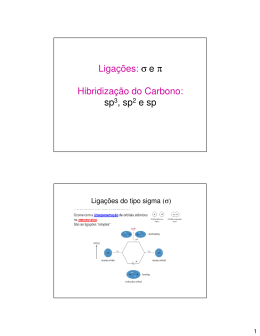
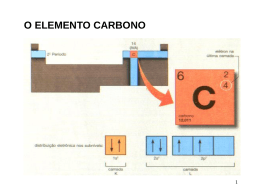
LIGAÇÃO COVALENTE: TEORIA DA LIGAÇÃO DE VALÊNCIA (TLV) LIGAÇÃO QUÍMICA Principais Tipos de Ligação Química Iônica Covalente Metálica E. Eletropositivo + E. Eletronegativo E. Eletronegativo + E. Eletronegativo E. Eletropositivo + E. Eletropositivo Iônica Covalente Metálica Ligação Covalente SOBREPOSIÇÃO ORBITAIS ATÔMICOS Ligação Covalente HA + HB HA HB Atração recíproca dos dois núcleos pelos elétrons TEORIA DA LIGAÇÃO DE VALÊNCIA (TLV) Linus Pauling Prêmio Nobel: Química e da Paz The Nature of the Chemical Bond TLV Sobreposição de Orbitais Atômicos Semi-Preenchidos Elétrons de Valência Localizados Entre os Núcleos Exemplos H2 HF Ligação Sigma F2 Formação de Ligações Sigma Ligação π Exemplo para N2 Moléculas Multicêntricas Como explicar: BF3, CH4, H2O, NH3, etc ????????????????????????????????????? Linus Pauling: Hibridização Mistura dos orbitais atômicos do átomo central (funções de onda) Linus Pauling: Hibridização Mistura dos orbitais atômicos do átomo central (funções de onda) Novo conjunto de orbitais (híbridos) Nova orientação/Nova Energia Maior região de sobreposição orbital Hibridização sp Molécula BeH2 180º H Be: 1s2 2s2 Be H Be: sp 2s + 2p sp Orbitais: pex; 2py e 2pz inalterados 1s2 2s2 2p Rearranjo eletrônico Combinação de 1 orbital s com 1 orbital p 2 Orbitais híbridos sp Linear BeH2 Hibridização sp Formação de dois orbitais SEMI-PREENCHIDOS sp •• •• F •• B •••• F •• Boron configuration ↑↓ ••• F• 1s •• ↑↓ 2s ↑ 2p Triangular Planar ângulo: 120º Hibridização sp2 B: sp2 2s + 2px + 2py sp2 sp2 Orbital: pex; 2pz inalterado 1s2 2s2 2p Rearranjo eletrônico Combinação de 1 orbital s com 2 orbitais p 3 Orbitais híbridos sp2 Hibridização sp2 Formação de três orbitais SEMI-PREENCHIDOS sp2 Hibridização sp3 oo 109 109 1s2 2s2 2p Configuração do C Hibridização sp3 C: sp3 2s + 2px + 2py + 2pz sp3 sp3 sp3 1s2 2s2 2p Rearranjo eletrônico Combinação de 1 orbital s com 3 orbitais p 3 Orbitais híbridos sp3 Hibridização sp3 o 109 109o Formação de quatro orbitais SEMI-PREENCHIDOS sp3 Hibridização sp3 NH3 Posição dos Átomos: Geometria Piramidal Par de elétrons lone pair of electrons livres na posição in tetrahedral positio tetraédrica N H H H Configuração do N 1s2 2s2 2p Rearranjo eletrônico Gera orbital híbrido com par de elétrons Formação de moléculas com dois ou mais centros “hibridizados” Implicações estruturais Exemplos: C2H6 C2H4 C2H2 Hibridização e Formação de Ligações Múltiplas (π) C2H4 H H 120Þ C H sp C H 2 Cada átomo de carbono hibridização sp2 1s2 2s2 2p Rearranjo eletrônico 3 orbitais híbridos sp2, disponíveis para formar ligações sigma Orbital inalterado para formação da ligação Pi C1-H C1-H =C =H C1-C2 C2-H C1-C2 C2-H Ligações Múltiplas: Ausência de livre rotação Restrição Energética da Rotação Mecanismo da Visão Rodopsina H N (Cis-retinal) Proteína hν H N Proteína Meta-Rodopsina (Trans-retinal) Large Structural Rearrangement hν N N hν /Δ Z E ISOMER N N o DISTANCE (Α) DIPOLE MOMENT (D) E 9,0 ZERO Z 5,5 3,0 hν1 hν2 hν1 hν2 Photoactive Dendrimers as Hosts hν H H H = CO2- H Br Br - O O O Br Br Eosin Y J. Am. Chem. Soc. 120, 12187 (1998) A. Archut, F. Vögtle, L. De Cola, G.C. Azzellini and V. Balzani Photoswitch Systems O N N NO2 O N N N Si N N N O2N N N λ = 410 nm N O N Δ (slow conversion) or λ = 675 nm (fast conversion) 1-E N N NO2 N N N Si N N N N N N O 1-Z N NO2 C2H2:Cada átomo de carbono hibridização sp 1s2 2s2 2p Rearranjo eletrônico 2 orbitais híbridos sp, disponíveis para formar ligações sigma Orbitais inalterados para formação da ligação Pi Formação de Ligações σ e π no C2H2
Baixar