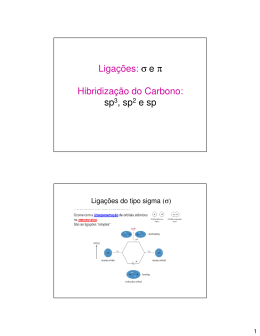
Estão presentes no nosso cotidiano. Álcool Comum Vinagre C2H6O C2H4O2 Petróleo e seus derivados. Alquimistas: - Extraiu-se o ácido cítrico (C6H8O7) do limão; - Extraiu-se a glicerina (C3H8O3) das gorduras animais. Em 1777, Bergman introduziu a expressão: COMPOSTOS ORGÂNICOS. De acordo com Bergman: -COMPOSTOS ORGÂNICOS: são substâncias extraídas dos organismos vivos; -COMPOSTOS INORGÂNICOS: são substâncias do reino mineral. Na época existia a concepção de que um simples composto orgânico não poderia jamais ser sintetizado pelo homem. Acreditava-se que para a produção desses compostos seria necessário a existência de "uma força vital" que somente existiria nos organismos vivos. Essa idéia, proposta por Jöns Jacob von Berzelius no ano de 1807, deu origem à Teoria da Força Vital ou simplesmente vitalismo. Berzelius Em 1828, as pesquisas em Química Orgânica foram ampliadas, principalmente após a descoberta de Woller. O NH4CNO Cianato de amônio H2N C NH2 Uréia Conceito atual: Química orgânica é um ramo da Química que estuda os compostos do elemento carbono, denominados compostos orgânicos. Importante: Existe um pequeno grupo de compostos que contém carbono, mas são estudados na química inorgânica por não apresentarem certas características comuns aos compostos orgânicos. São os chamados compostos de transição. Como exemplos: NH4CNO – Cianato de amônio; CO2 – Gás carbônico; HCN – ácido cianídrico. Propriedades gerais: Tipo de ligação: apresentam ligações covalentes, por isso os compostos orgânicos não são bons condutores de eletricidade. PF, PE e Estabilidade térmica: Apresentam baixos PF e PE com atração entre suas moléculas reduzida, devido a ausência de cargas elétricas. O açúcar é orgânico e o sal é inorgânico e apresenta maior estabilidade térmica, uma vez que o açúcar derrete facilmente. A velocidade de reação dos compostos orgânicos é lenta, e catalisadores. geralmente necessitam de Exemplo: a hidrogenação de óleos, que melhora a estabilidade do óleo e modifica a sua textura. Uma hidrogenação completa modifica a textura do óleo endurecendo-o para produzir a margarina. Solubilidade: A maioria dos compostos orgânicos é pouco solúvel ou insolúvel em água. As mãos sujas de graxa devem ser lavadas em solvente orgânico: Gasolina. Fibras sintéticas, alimentos, cosméticos, medicamentos e combustíveis são alguns dos produtos que envolvem milhões de substâncias em que o principal componente é o mais extraordinário dos elementos químicos, o: Carbono. Friedrich August Kekulé von Stradonitz foi um químico alemão que em 1857 determinou as características fundamentais do átomo de carbono nos compostos. O carbono é tetravalente Trata-se do primeiro postulado de Kekulé, que atribui ao carbono a possibilidade de quatro ligações. H H C H H Cl H H C H H C Cl H H CH3Cl H H C H Cl H Cl C H H As quatro valências são iguais entre si O Carbono forma ligações múltiplas H Ligação SIMPLES (Sigma) H H C C H H H H Ligação DUPLA (Uma sigma outra pi) H C C H H H Ligação TRIPLA (Uma sigma e duas pi) C C H O Carbono forma cadeias H H H H C C H H H CH3 H C CH2 H H C H H C H H C H H H C C H N H H H C H H C H CH CH2 CH3 CH2 CH3 H C H H C H H C H H Os tipos de cadeia orgânica: -Quanto ao fechamento da cadeia Acíclica ou aberta Cíclica ou fechada -Quanto à disposição dos átomos: Normal Ramificada -Quanto aos tipos de ligações: Saturada Insaturada -Quanto à natureza dos átomos: Homogênea: Na cadeia, existe apenas átomos de carbono Heterogênea: Na cadeia, existe átomos de outros elementos (heteroátomos) -Classificação dos carbonos na cadeia: Secundário Primário Terciário Quaternário -Hibridização O carbono sofre hibridização, ou seja, mistura de orbitais. Existem três tipos de hibridização para o carbono: sp3, sp2 e sp. Orbitais x s orbital px orbital z y pz orbital py orbital Hibridização 3 sp •É a mistura de 3 orbitais p + 1 orbital s = 4 novos orbitais “híbridos” denominados sp3; •A geometria dos 4 orbitais sp3 é tetraédrica; •O ângulo será de aprox.109°; •Acontece no C que se liga através de 4 ligações simples (o C é tetravalente). 2p hibridação sp3 H H H H Hibridização 2 sp • É a mistura de 1 orbital s + 2 orbitais p = 3 novos orbitais denominados híbridos sp2. • O ângulo será de 120° (geometria trigonal plana). • Acontece com C que possui uma dupla ligação. • Num C do tipo sp2 existirá um orbital p “puro” que será responsável pela ligação covalente do tipo pi. H2C=CH2 Molécula de eteno (etileno). Os dois átomos de C encontram-se ligados por uma dupla ligação (uma ligação sigma sp2-sp2 e uma ligação pi). Cada átomo de C encontra-se ligado a dois átomos de H (duas ligações sigma s-sp2). HIBRIDIZAÇÃO DO CARBONO sp2 Etileno H H C C H H Cada carbono é hibrido sp2 . O hidrogênio é 1s. Uma ligação da dupla é sp2 - sp2. A outra é p - p. 2p 2p hibridação 2s sp2 Hibridação sp • É a mistura de 1 orbital s + 1 orbitais p = 2 novos orbitais denominados híbridos sp. • Assim existem dois orbitais híbridos sp e dois orbitais p “puros”. • Num C do tipo sp existirá um orbital p “puro” que será responsável pela ligação covalente do tipo pi. • Ligação tripla uma ligação e duas ligações p Fórmula estrutural do acetileno (etino) H C C H Cada átomo de carbono é um híbrido sp. Os hidrogênios possuem orbitais 1s, não hibridizados. 2p 2p hibridação sp 2s Observe que a tripla ligação consiste de uma e 2p . As duas ligações p provem dos orbitais p, não hibridizados. H C C H H C C H Função orgânica: É um conjunto de substâncias com propriedades químicas semelhantes denominadas de propriedades funcionais. Para estudo das funções, é preciso iniciarmos o estudo da sua nomenclatura, que exige o cumprimento de normas estabelecidas pela IUPAC (Union of Pure and Applied Chemistry). Para tanto, vamos iniciar o estudo dos prefixos... Número de carbonos Prefixo 1 2 3 4 5 6 7 8 9 10 Met Et Prop But Pent Hex Hept Oct Non Dec Radicais orgânicos e seus nomes: Regras fundamentais na nomenclatura dos compostos: 1) Considerar, como cadeia principal, a cadeia mais longa; se há várias de mesmo comprimento, escolha como cadeia principal a mais ramificada; 2) Numerar a cadeia de modo que as ramificações recebam os menores números possíveis (regra dos menores números); 3) Citar as ramificações, em ordem alfabética, precedidas pelos seus números de colocação na cadeia principal e finalizar com o nome correspondente à cadeia principal. Ramificação / Cadeia Os HIDROCARBONETOS, são compostos orgânicos formados exclusivamente por: carbono e hidrogênio. Alcanos: São os principais formadores do petróleo. Os alcanos apresentam apenas ligações simples. Alcenos: Matéria-prima na fabricação de plásticos e fibras têxteis. Possuem duplas ligações. Alcinos: Usados na fabricação de plásticos e solventes. Possuem tripla ligação. Resumindo: Nomenclatura: alcanos Prefixo + an + o alcenos Prefixo + en + o alcinos Prefixo + in + o Acompanhe os exemplos a seguir CH4 METANO CH3____CH3 ETANO ETENO CH3 PROPENO ETINO CH3 CH3 CH CH2 CH2 CH3 2-metil pentano Radical Cadeia 2,2,4-trimetilpentano 3 – metil-hexano
Baixar