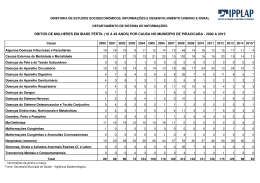
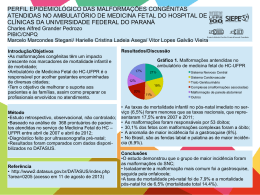
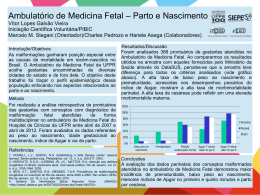
DOENÇAS AMBIENTAIS E MULTIFATORIAIS Genética Humana Profa. Dra. Ana Elizabete Silva Departamento de Biologia PERDAS GESTACIONAIS ~15% das gestações reconhecidas terminam em aborto Causas cromossômicas: 50 - 60% dos abortamentos espontâneos DEFEITOS CONGÊNITOS (3-5% dos recém-nascidos vivos apresentam algum defeito congênito) Causas genéticas: 15 - 20% Fatores ambientais: 7 - 10% Multifatorial: 20-25% Causa desconhecida: >50% TERATOGÊNESE HUMANA Agente teratogênico: qualquer substância, organismo, agente físico ou estado de deficiência que, estando presente durante a vida embrionária ou fetal, produz uma alteração na estrutura ou função do concepto. Agente mutagênico: altera o material genético das células germinativas e/ou somáticas DEFEITO CONGÊNITO (BIRTH DEFECT): Toda anomalia funcional ou estrutural do desenvolvimento do feto decorrente de fator originado antes do nascimento, seja genético, ambiental ou desconhecido, mesmo quando o defeito não for aparente no recém-nascido e só manifestar-se mais tarde. ESTIMATIVA: ser humano exposto a cerca de 5 milhões de diferentes substâncias químicas Exposição ambiental: bomba atômica, acidentes nucleares, pesticidas, poluentes ambientais, contaminação industrial Apenas 1500 foram testadas em animais Cerca de 30 são comprovadamente teratogênicas no homem (dificuldades de investigações de teratogenicidade nos humanos) Estudos em animais: base de triagem → restrição → diferenças genéticas entre as espécies EXEMPLO: corticosteróides: potente teratógeno em roedores e aparentemente seguro no homem talidomida: potente teratógeno no homem e aparentemente seguro para a maioria dos animais Por que a exposição humana a agentes externos causadores de malformações não apresenta sempre os mesmos resultados? Por que mães expostas a esses agentes químicos, físicos ou biológicos nem sempre geram indivíduos portadores de malformações? 1-Estágio de desenvolvimento do concepto no momento as exposição: 2 primeiras semanas, efeito “tudo-ou-nada”; entre 3a-8a sem. período mais crítico p/ malformações; após , efeitos principalmente no SNC e crescimento fetal. 2. Relação entre dose-efeito: desenvolvimento anormal aumenta conforme o aumento da dose do agente (desde nenhum efeito, danos funcionais e malformações até a morte) 3. Genótipo materno-fetal (diferenças inter-específicas e intraespecíficas) : heterogeneidade genética da mãe e do feto pode conferir maior suscetibilidade ou resistência a um agente 4. Mecanismo patogênico específico de cada agente sobre as células: alterando o crescimento, diferenciação celular ou morfogênese fetal e provocando morte celular. Períodos críticos do desenvolvimento intra-uterino Pré-diferenciação (1-15 dias): lei do tudo ou nada Fase embrionária – a mais prejudicada 15-25 dias – cérebro 24-40 dias – olhos 24-40 dias – coração 24-36 dias – membros 45 dias ou mais – genitalia Fase fetal: (61 – 200 dias) – sensibilidade menor aos agentes → atraso do crescimento ou alterações funcionais DANOS REPRODUTIVOS Retardo de crescimento intra-uterino Morte do Concepto Malformações Deficiências funcionais - RM SIAT: Serviço de Informação sobre Agentes Teratogênicos Serviço especializado em fornecer informação a médicos e pacientes em geral sobre riscos reprodutivos, relacionados à exposição de mulheres grávidas Implantado no Serviço de Genética Médica – Hospital de Porto Alegre – 1990 Objetivos: Prevenção do aparecimento de defeitos congênitos decorrentes de exposições ambientais Aprofundamento do conhecimento a respeito da teratogênese humana [email protected] www.hcpa.ufrgs.br/siat Outros SIATs: RJ, Salvador, SP e Campinas ESTUDO COLABORATIVO LATINOAMERICANO DE MALFORMAÇÕES CONGÊNITAS (ECLAMC) •Sede: Instituto Oswaldo Cruz – RJ 70 hospitais 10 países da América do Sul e Caribe •Objetivos : •Registro de Defeitos Congênitos em RN •Prevenções das malformações congênitas • Investigação dos defeitos congênitos • Estudo epidemiológico CAMPO 34 DA DECLARAÇÃO DE RECÉM-NASCIDO VIVO (DNV) •1999: CAMPO 34 •define a presença ou não de malformação congênita O Campo 34 deve ser preenchido, conforme o caso, em três etapas: O caput traz a seguinte pergunta: “Detectada alguma malformação congênita e/ou anomalia Cromossômica? sim, não e ignorado • O item seguinte, “Qual?” é questão aberta para descrição do problema diagnosticado e permite o registro de um ou mais tipos de defeitos. • Por último, há caselas para anotação do código correspondente à descrição, de acordo com a Classificação Internacional de Doenças - CID • Preenchimento facultativo??? Importância estatística. MEDIDAS DE PREVENÇÃO PRIMÁRIA DE ANORMALIDADES CONGÊNITAS Prevenção de infecções congênitas: vacinação 3 meses antes da concepção. Campanha de imunização de mulheres (2001) Evitar uso de drogas de adição (álcool, fumo, cocaína) Uso periconcepcional de ácido fólico: diminui a possibilidade de defeitos congênitos (dose recomendada: 4mg/dia um mês antes da concepção e mantendo até o 3º mês de gestação) Fortificação da farinha (2004): ferro e ácido fólico Evitar uso de medicamentos durante a gestação e amamentação Exposições ocupacionais Mulheres portadoras de patologias crônicas (epilepsia, diabetes, hipertensão arterial, doenças psiquiátricas) FORTIFICAÇÃO DA FARINHA COM ÁCIDO FÓLICO •Combater os defeitos de fechamento do tubo neural • Ação conjunta: Agencia Nacional de Vigilância Sanitária (ANVISA), OMS, Organização Pan-Americano da Saúde (OPAS) • Eficácia não confirmada http://pt.slideshare.net/cdfeszaragoza/agentes-teratogenos DOENÇAS MATERNAS 1. Fenilcetonúria materna 2. Diabetes mellitus 3. Radiação 4. Talidomida 5. Álcool 6. Hidantoína 7. Rubéola 8. Toxoplasmose TERATÓGENOS MATERNOS: FENILCETONÚRIA MATERNA Níveis elevados de fenilalanina materna: prejudicam a mielinização e maturação do SNC Mãe não tratada: 80% de chance de ter filho com anomalias congênitas Prevenção: dieta rígida da mãe, com níveis baixo de fenilalanina plasmática da concepção ao nascimento TERATÓGENOS MATERNOS: FENILCETONÚRIA MATERNA Manifestações clínicas: Microcefalia, glabela proeminente Atraso do crescimento intrauterino RM 20% risco de defeito cardíaco congênito Palato fendido Prega epicântica, estrabismo clinodactilia TERATÓGENOS MATERNOS: DIABETES MELLITUS Controle do diabetes no período préconcepcional e primeiras 8 semanas de gestação Quadro clínico: Crianças grandes com malformações Tendência a hipoglicêmia Defeitos do tubo neural Defeitos cardíacos Anomalias renais Atresia intestinal Anoftalmia, microftalmia Fenda labial/palatina Morte neonatal DIABETES EXPERIMENTAL AGENTES FÍSICOS: RADIAÇÃO Raios X: efeito mutagênico (gônadas) e teratogênico (gravidez) tratamento materno durante a gestação pode provocar malformações congênitas Manifestações: Microcefalia Espinha bífida Microftalmia Palato fendido Micromelia RM Irradiação dos ovócitos → ↑ aneuploidias → aborto e malformações Irradiação masculina: dose ~100R (suficiente para destruir espermatogônias → esterilidade masculina) ou aberrações cromossômicas → risco abortos e malformações AGENTES FÍSICOS: RADIAÇÃO Descendentes de mulheres grávidas japonesas expostas a bomba atômica: microcefalia e RM, morte fetal e neonatal Relação com a dose e estágio do desenvolvimento do embrião/feto OMS: níveis máximos de radiação: 1,5 R/ano: órgãos do corpo 0,5 R/ano: gônodas Irradiação permanente de baixa dosagem, menos perigosa que de curta duração mas alta dose AGENTES QUÍMICOS: TALIDOMIDA 1956: remédio contra influenza → usado como sedativo contra náuseas e vômitos na gravidez Período crítico: 34 a 50 dias após última menstruação (2 semanas embrionárias) A partir de 1962: retirado do mercado 1966: registrado 7 mil recémnascidos na Europa e 1 mil no Japão atingidos pela talidomida a-ptalimido-glutaramida AGENTES QUÍMICOS: TALIDOMIDA Manifestações: Amelia (ausência total) Focomelia Doença cardíaca congênita Microftalmia Anomalias intestinal e renal Deformidades das orelhas (microtia, surdez) AMELIA Mecanismos: Diminuição da expressão de receptores ligados a adesão celular → alterações nas interações célulacélula e célula-matriz extracelular Inibição da transcrição de genes responsáveis pela angiogênese dos brotos dos membros AGENTES QUÍMICOS: SÍNDROME DO ÁLCOOL FETAL Álcool: teratógeno mais frequente Incidência: USA: 1/750 → 2-5% mulheres abusam do álcool França: 1/212 Suécia: 1/300 Brasil: 30,4% grávidas → consumo de álcool Ingestão materna: >150g de álcool/dia (4-6 copos/dia) Níveis menores de ingestão: 2 copos/dia → são prejudiciais Mecanismo teratogênico: leva a hipoxia fetal e retardo do crescimento intra-uterino por interferir na circulação placentária e fetal AGENTES QUÍMICOS: SÍNDROME DO ÁLCOOL FETAL Manisfetações clínicas: Atraso do crescimento (deste intrauterino) RM (QI= 63) Comprometimento dos movimentos delicados Irritabilidade e hiperatividade Microcefalia Fendas palpebrais pequenas Micrognatia Lábio superior fino Fenda labial/palato Sopro cardíaco Diminuição no. neurônios http://72.21.62.210/alcooledrogas/complicacoes_gravidez_sindrome.htm AGENTES QUÍMICOS: SÍNDROME DA HIDANTOÍNA FETAL Hidantoína: anticonvulsivantes, antiepiléticos (Hidantal) Administração no primeiro trimestre de gestação Combinação de barbitúricos c/hidantoína: aumenta o perigo ao feto Recomendação na gravidez: monoterapia e a menor dose possível Incidência: 5-10% dos fetos expostos Mecanismo de ação: redução na disponibilidade dos derivados do ácido retinóico AGENTES QUÍMICOS: SÍNDROME DA HIDANTOÍNA FETAL Manifestações clínicas: Atraso do crescimento intrauterino e 1os. Meses de vida RM (QI= 71) Microcefalia Microftalmia Hipertelorismo, estrabismo Base nasal larga e achatada Fenda labial/palatal Hérnia umbilical/inguinal Hirsutismo facial Defeitos cardíacos DOENÇAS INFECCIOSAS: SÍNDROME DA RUBÉOLA FETAL Transmitida no 1º. trimestre de gestação: vírus (Togavírus) → afinidade por tecidos jovens → lesando órgão da visão, audição, SC e SN Formas de infecção: secreção nasofaríngea, sangue, fezes e urina Evolução: perigo também durante o 2º Trimestre vírus: capaz de se manter por muito tempo no interior das células → alterações anatomopatológicas anos após o nascimento Diagnóstico laboratorial: pesquisa de anticorpos específicos (IgG e IgM) Profilaxia da rubéola materna: vacina atenuada (90 dias antes da concepção) Diagnóstico Pré-Natal: cordocentese (17semanas) anticorpos IgM específicos PCR p/vírus da rubéola (líquido amniótico) DOENÇAS INFECCIOSAS: SÍNDROME DA RUBÉOLA FETAL Manifestações clínicas: Morte fetal Atraso do crescimento Microcefalia Surdez Catarata, glaucoma Microftalmia Estrabismo Estenose pulmonar DOENÇAS INFECCIOSAS: TOXOPLASMOSE Infecção por Toxoplasma gondii (protozoário): 10 - 24 semanas Forma congênita: parasita atravessa a placenta e invade o tecido fetal (apenas quando a doença adquirida durante a gravidez) Forma adquirida: geralmente sem manifestações clínicas ou subclínicas, raramente resulta em encefalite e pneumonia Transmissão: animais domésticos (urina e fezes); carnes mal cozidas, ovos crus, leite não pasteurizado; transfusão de sangue Incidência: USA: 1-6/1000 RN Europa: 0,2-5/1000RN América Sul: 10-20/1000RN DOENÇAS INFECCIOSAS: TOXOPLASMOSE Manifestações clínicas: Hidrocefalia e microcefalia Mudanças destrutivas no cérebro e olho Calcificações cerebrais Alterações oculares (coriorretinite) Surdez RM Autismo Hipogenitalismo e puberdade precoce coriorretinite Risco de transmissão p/feto: 15% - infecção materna adquirida no 1o. Trimestre 30% - se ocorrer no 2o. Trimestre 60% - durante o 3o. Trimestre Próxima ao parto: risco de transmissão elevada e manifestação no RN subclínica DOENÇAS INFECCIOSAS: TOXOPLASMOSE Tratamento materno: apenas no 2º e 3º trimestre de gestação (mulheres recém infectadas) com primetamina (teratogênica no 1º trimestre) → reduz em 60% a infecção do feto 1º trimestre: espiramicina ou sulfadiazina → até final da gestação Tratamento de criança: logo após início do aparecimento dos sinais Diagnóstico laboratorial: IgG, IgM e IgA específicas Diagnóstico Pré-Natal: sangue fetal ou líquido amniótico: testes p/anticorpos específicos PCR p/detecção do toxoplasma ACONSELHAMENTO GENÉTICO Diagnóstico diferencial com outras doenças gênicas, cromossômicas e multifatoriais Anamnese: informações da mãe sobre exposição aos possíveis teratógenos Risco de recorrência: variam em cada situação Doenças infecciosas: risco desprezível → mãe imunizada Agentes químicos e físicos: término da exposição → nenhum risco Doença materna: risco alto → caso a mãe não tenha os cuidados necessários HERANÇA MULTIFATORIAL DOENÇAS COMPLEXAS Traço determinado por uma combinação de fatores genéticos e ambientais o caráter é determinado pela interação de vários genes em locos diferentes, cada um com efeito pequeno mais aditivo (poligenes) Grande variabilidade fenotípica HERANÇA MULTIFATORIAL DOENÇAS COMPLEXAS Heredograma: não possibilita um diagnóstico de herança multifatorial risco de recorrência (risco empírico): frequência de repetição observada em amostras adequadas da população são doenças comuns na população: 1/1000 CLASSIFICAÇÃO Caracteres multifatorias contínuos: caráter quantitativo -distribuição gradativa contínua (curva normal Gauss) -Ex.: altura, peso, pressão sanguínea Caracteres multifatoriais descontínuos (Dicotômicos): caráter qualitativo a- Malformações Congênitas b- Doenças da Vida Adulta EFEITO LIMIAR Exemplos: defeitos de fechamento de tubo neural, lábio e palato fendidos, estenose pilórica EFEITO LIMIAR DEFEITO DE FECHAMENTO DE TUBO NEURAL - DFTN Falha no fechamento do tubo neural:25-28 dias incidência varia de acordo com a população: (1/700 RN) Irlanda: 6 em cada 1000 nascidos vivos Estados Unidos: 1-2 em cada 1000 nascidos vivos mais freqüente no sexo feminino mais freqüente após casos mais graves influência ambiental ( risco) : hipertermia gestacional uso de drogas na gestação (ácido valpróico) Diabetes materna deficiência de ácido fólico DEFEITO DE FECHAMENTO DE TUBO NEURAL - DFTN Tipos de DFTN: Craniorraquisquise: abertura completa do TN Anencefalia: ausência do cérebro Encefalocele:crânio-bífido Diferentes níveis da espinha: Meningocele Mielomeningocele Espinha bífida oculta CRANIORRASQUIQUISE •Falha no fechamento do comprimento total do tubo neural •letal Desenvolvimento parcial dos ossos frontal, parietal e ocipital; olhos protusos http://escuela.med.puc.cl/paginas/Cursos/tercero/patologia/fotosMalformaciones4.html ENCEFALOCELES ESPINHA BÍFIDA http://www.prefeitura.sp.gov.br/cidade/secretarias/upload/saude/arquivos/sinasc/SINASC_ManualAnomaliasCongenitas.pdf Deficiência de Ácido Fólico Materno Níveis sorológicos de ac. Fólico materno durante a gravidez < 200ug/L Níveis de homocisteína elevados Associação com polimorfismos da enzima metilenotetrahidrofolato redutase MTHFR C677T (mudança do aminoácido alanina para valina) e A1298C (substituição do aminoácido glutamato por alanina): enzima menos estável → interfere com a metilação da homocisteína para metionina Mães de bebês com DTN são 2X mais prováveis de serem homozigotos para o alelo polimórfico Prevenção: 4mg folato um mês antes da concepção até dois meses após (redução de 75% da incidência de DTN) ACONSELHAMENTO GENÉTICO Risco de recorrência: ~3% Os riscos de recorrência podem mudar substancialmente de uma população para outra Diagnóstico Pré-Natal: -dosagem de alfa-fetoproteína do soro materno - dosagem de alfa-fetoproteína do líquido amniótico -ultrassom ~ 19 semanas DOENÇAS DA VIDA ADULTA Artrite reumatóide Esclerose múltipla Epilepsia Esquizofrenia Distúrbio afetivo Autismo Doenças cardíacas coronárias receptor de LDL e apolipoproteínas Diabetes mellitus Obesidade (H2 = 60-80%) hormônio leptina e seu receptor Alcoolismo: Tipo II (H2=88%) receptor D2 de dopamina Doença de Alzheimer http://www2.ufpel.edu.br/biotecnologia/gbiotec/site/content/paginadoprofessor/uploadsprofessor/eb0d397460aba579ac7b60efa0344e d5.pdf?PHPSESSID=45c6b7803bcab4e8a04ef5c811b8f6b6 O risco de recorrência é muito maior para parentes em 1º. Grau do que parentes mais distantes Nos monogênicos 50% a cada grau de parentesco. 50% irmãos, 25% para tiosobrinho, 12,5% primos em primeiro grau
Baixar