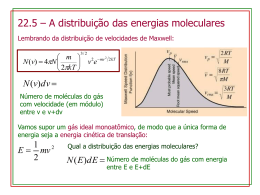
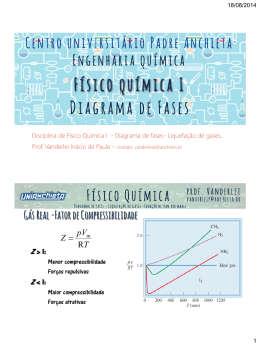
UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA 1º CURSO INTER-SEMESTRAL - 2012 Físico-Química Aulas da primeira semana: • 16/01 – 08:00 h • 18/01 – 08:00 h • 20/01 – 08:00 h 17/01 – 08:00 h 14:00 h 08:00 h Avaliação P1 – 30 de janeiro P2 – 13 de fevereiro Gases reais Desvio do comportamento ideal Os gases reais exibem desvios em relação à lei dos gases perfeitos em virtude das interações moleculares. As forças repulsivas contribuem para expansões e as atrativas para compressões. Os desvios são mais pronunciados a elevadas pressões, em virtude do predomínio das forças de repulsão (o gás se torna menos compressível). A quantificação deste desvio de comportamento é feita pelo fator de compressibilidade (Z), que varia em função da pressão. Onde, Vm é o volume molar do gás (também representado por V- ). Para o gás ideal Z = 1, ou seja, não há força de repulsão nem de atração, independente da pressão (em temperatura constante). O desvio do comportamento ideal não é igual para qualquer gás. Modificação da equação ideal 1. Equação de van der Waals (em homenagem a Johannes Diderik van der Waals, 1837-1923) - Leva em consideração o volume das moléculas e as forças de interação entre elas. A. As forças intermoleculares de atração fazem com que a pressão medida de um gás seja “menor” que a pressão que ele exerceria caso se comportasse idealmente. Essa diminuição de pressão é proporcional ao quadrado da concentração do gás (n2/V2). Assim, para corrigir o desvio em relação à pressão, o termo a.(n2/V2) foi adicionado à equação dos gases ideais. B. Por outro lado, o volume das moléculas do gás real é “maior” que do gás ideal, devendo-se, então, subtrair do volume do gás ideal, o fator de correção n.b, que representa o volume de todas as moléculas de uma determinada quantidade do gás. As constantes a e b são características de cada gás. van der Waals, com base em dados experimentais e uma análise termodinâmica rigorosa, propôs a seguinte equação: Onde a é a constante de proporcionalidade, expressa em atm.L2.mol-2, pois a.(n2/V2) tem que ter unidade de pressão. b é o fator relacionado ao volume da molécula, e é expresso em L.mol-1, pois n.b tem que ter unidade de volume. O cálculo de Z para um gás de van der Waals, leva à seguinte expressão: Esta expressão mostra que os termos responsáveis pelo comportamento não ideal desaparecem não só para pressões que tendem a zero, mas também para temperaturas que tendem ao infinito. Assim, como regra geral, os gases reais estão mais próximos da idealidade a baixas pressões e a altas temperaturas. O comportamento da curva de Z (“de van der Waals”) em função da pressão, em diferentes temperaturas, permite encontrar um temperatura em que o gás real tem comportamento ideal numa ampla faixa de pressão. Neste caso, os efeitos do volume das moléculas e das forças intermoleculares são praticamente compensados. Esta temperatura é chamada de Temperatura de Boyle, e é dada por: Isotermas de um gás real As isotermas de um gás real revelam as conclusões de que este se comporta idealmente a baixas pressões e a altas temperaturas. Fig. 1.23 Isotermas do dióxido de carbono levantadas experimentalmente. A isoterma crítica está a 31,04 oC e o ponto crítico está assinalado por um asterisco. Temperatura crítica: temperatura acima da qual um gás não pode ser liquefeito, independente de quão grande seja a pressão. Continuidade dos estados O princípio da continuidade dos estados se deve ao fato de que nem sempre é possível distinguir um líquido de um gás. Ou seja, estes dois estados podem ser transformados um no outro continuamente. Na ausência de uma superfície de descontinuidade, não existe um modo fundamental de distinguir entre líquido e gás. Isotermas da equação de van der Waals Quando o volume é muito grande, a equação de van der Waals se aproxima da lei dos gases ideais, para qualquer temperatura: Em temperaturas elevadas, o segundo termo à direita pode ser ignorado, uma vez que é muito pequeno comparado com o primeiro termo. Em temperaturas baixas e volumes menores, nenhum dos termos pode ser desprezado. Linha DC vapor supersaturado ou super-resfriado (estado metaestável) Linha AB líquido superaquecido (estado metaestável) Linha BC risco de explosão ou colapso do sistema O estado crítico Efetuando-se o parênteses da equação de van der Waals e multiplicando o resultado por Vm2/p, tem-se: Esta equação tem 3 raízes, para certos valores de temperatura e pressão. Estas raízes estão dentro da região de coexistência de duas fases ou nos seus limites. Como esta região diminui e se fecha no topo, existe uma condição de pressão máxima pc e temperatura máxima Tc na qual as duas fases podem coexistir. Essa condição é o ponto crítico, e o volume correspondente é o volume crítico Vc. No ponto crítico as três raízes da equação são iguais a Vc, já que precisam permanecer na fronteira ou dentro desta. - - Das duas formas de se escrever a equação anterior: e chega-se a: 1. Resolvendo-se as 3 equações anteriores para Tc, pc e Vc, em função de a, b e R, tem-se: - Expressões que permitem obter as variáveis críticas, conhecendo-se a e b. 2. Resolvendo-se as 3 equações anteriores para a, b e R em função de Tc, pc e Vc, tem-se: - Expressões que permitem obter as constantes, conhecendo-se as variáveis críticas. Entretanto, o valor de R obtido desta forma diverge bastante do valor conhecido. Além disso, é difícil determinar Vc experimentalmente. Assim, faz-se: - que, substituído nas duas primeiras expressões anteriores, permite obter a e b a partir de Tc e pc: Apesar de serem relações aproximadas, devido à nãoconfiabilidade da equação de van der Waals na região crítica, são frequentemente utilizadas para obter as constantes de van der Waals. Outras equações de estado Exercícios A temperatura crítica do etano é igual a 32,3ooC e a pressão crítica é igual a 48,2oatm. Calcule seu volume molar crítico, usando a) a equação dos gases ideais, b) a equação de van der Waals (lembrando que, neste caso, pc.Vmc/RTc = 3/8), c) a equação de Berthelot. Compare os resultaldos com o valor experimental de 0,139 L/mol. Usando os dados tabelados das constantes de van der Waals, calcule a pressão exercida por 2,500 mols de dióxido de carbono confinados em um volume de 1,000 L, a 450 K. Compare o resultado com a pressão obtida supondo comportamento ideal.
Baixar