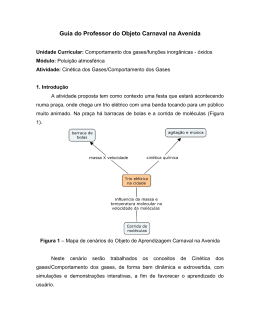
Alunos: Derik Maia Silva Douglas Teixeira Nº18699 Nº18700 Características dos Gases Possuem forma e volume indefinidos; Formam misturas homogêneas; Possuem alta compressibilidade devido ao grande espaçamento entre suas moléculas; Possuem baixa densidade. Pressão Pressão é a força F agindo sobre uma área A. Os gases exercem pressão na superfície em que estão em contato. Pressão Atmosférica • É a pressão exercida por uma coluna de gás de 1 m2 de secção transversal cuja altura vai até o topo da atmosfera. Essa coluna aplica uma força de 1,01 x 105 N. Patm = 1 x 105 N/m² = 1 x 105 Pa = 760 mmHg = 1 atm Leis dos Gases O estado de um gás ideal pode ser definido pelas seguintes variáveis: pressão (P), volume (V), temperatura (T) e quantidade de matéria (n). Lei de Boyle; Lei de Charles; Lei de Avogadro. Lei de Boyle Temperatura constante; O volume de certa massa de gás perfeito é inversamente proporcional à pressão suportada. P . V = K (constante) Lei de Charles Pressão constante; O volume é diretamente proporcional à temperatura absoluta do gás. V / T = K (constante) Lei de Avogadro • Pressão e Temperatura constantes; • O volume é proporcional ao número de moléculas. V / n = K (constante) 6,02 x 1023 moléculas = 22,4 L (CNTP) Equação dos Gases Ideais PV=nRT V – volume P – pressão n – quantidade (mols) R – constante T – temperatura (K) Densidade dos Gases PV nRT PM m RT V m PV RT M PM d RT Misturas de Gases e Pressões Parciais A pressão total da mistura gasosa é a soma das pressões parciais que cada gás exerceria se estivesse sozinho (Lei de Dalton). Pt = P1 + P2 + ... + Pn Teoria Cinética Molecular •Postulados: 1. 2. 3. 4. 5. As moléculas dos gases estão em movimento contínuo e aleatório O volume de todas as moléculas do gás é desprezível se comparado ao volume onde o gás está contido As forças atrativas e repulsivas entre as moléculas são desprezíveis A energia cinética média das moléculas não varia com o tempo se não houver variação de temperatura, e portanto, as colisão são elásticas A energia cinética média é proporcional à temperatura. A pressão é provocada pelas colisões das moléculas com as paredes do recipiente onde encontra-se o gás. A temperatura absoluta é uma medida de energia cinética média de suas moléculas (quanto maior a temperatura maior a energia cinética média). Efusão e Difusão Da teoria cinética molecular temos que: 3RT u M u representa a velocidade quadrática média (vqm). Efusão e Difusão Conceitos: Efusão é o escoamento de partículas através de uma pequena abertura ou orifício. Difusão é o espalhamento de uma substância no espaço ou em uma segunda substância. Lei de Graham Graham afirmou que a taxa de efusão de um gás é inversamente proporcional à raiz quadrada de sua massa molar. Dessa forma, quanto mais leves as moléculas de gás, maior a velocidade vqm, u. r1 r2 M2 M1 Gases Reais: Desvios do comportamento ideal em função da pressão. • A altas pressões, os gases tendem a se desviar do comportamento ideal, gerando sérios erros quando utilizada a equação dos gases ideais. P.V R.T P (atm) A altas pressões, a distância entre as moléculas diminui, aumentando as forças atrativas entre elas. Assim, a força das colisões com o recipiente diminuem, diminuindo a pressão. Nesse caso, a pressão se torna mais baixa em relação ao gás ideal. Gases Reais: Desvios do comportamento ideal em função da temperatura. • A baixas temperaturas esse desvio torna-se cada vez mais significante à medida que se aproxima da temperatura na qual se liquefaz. • Quando a temperatura cai, a velocidade das moléculas diminui, fazendo com que elas tenham uma maior dificuldade em vencer a força atrativa. Equação de Van der Waals Van der Waals corrigiu a equação dos gases ideais, elaborando uma equação empírica que levasse em conta as forças atrativas e o volume finito delas. a (L² atm / mol²) e b (L / mol) – constantes de Van der Waals Referências bibliográficas - Química: A Ciência Central, 9ª ed.. Brown, LeMay, Bursten - http://www.elcio.unifei.edu.br/teoria/semin ários - http://pt.wikipedia.org/wiki/G%C3%A1s#Te oria_cinética (09-09-10)
Baixar