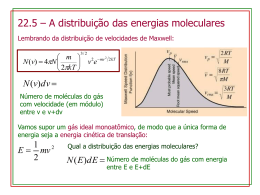
Projeto Vácuo-Mecânico-Estrutural do Padrão Primário de Vácuo Leandro Toshio Filoni e Francisco Tadeu Degasperi Faculdade de Tecnologia de São Paulo – Fatec-SP – CEETEPS – UNESP – São Paulo – SP – Brasil e-mail: [email protected] 1. Introdução 7 1.8.10 Um padrão primário é um arranjo pensado para obter medidas de confiança para calibração de outros instrumentos, que seriam os padrões secundários. No Laboratório de Tecnologia de São Paulo, foram feitas experiências considerando o medidor McLeod como padrão primário. Neste trabalho utilizaremos outro tipo de padrão primário que tem como base teórica expansões sucessivas isotérmicas (Lei de BoyleMariotte). A metrologia para construção de um padrão primário é importante para padronizar a construção e sempre que possível modificar a construção do projeto de modo a ter uma incerteza relacionada as medidas cada vez menor. 7 1.7.10 7 1.6.10 pressão (Pa) 7 1.5.10 7 1.4.10 7 1.3.10 7 1.2.10 7 1.1.10 1 .10 7 9 .10 6 8 .10 6 7 .10 6 4 1.5.10 2 .10 2. Método Experimental pinicial ⋅ vmenor (vmenor + Vmaior ) 4 2.5.10 3.10 4 4 3.5.10 Volume molar (m³/mol) Partiremos de uma pressão inicial medida por um manômetro absoluto, com pequena incerteza relativa e em seguida expandimos o gás para uma câmara de vácuo maior. Admitindo a validade da lei de BoyleMariotte, encontramos a pressão final. Pfinal = 4 Van der Waals- T=300K Gás Ideal - T=300K Fig. 1 Comparação entre Equação de Van der Waals e Equação dos Gases Ideais. 4. Conclusões (1) O gás, ao expandir, ocupará um volume maior, conseqüentemente, a pressão que o gás exercerá em relação ao novo volume (após a expansão) é menor que a pressão antes da expansão. Para conseguir valores de pressão, usando este método que podemos dizer que um divisor de pressão, é necessário o conhecimento das razões de volumes, isto é, o volume inicial – antes da expansão – dividido pelo volume final – depois da expansão. 3. Resultados e Discussões Tivemos um estudo em relação ao comportamento do gás (Ideal ou Real). Através de dados retirados de [2] observamos que para nossos parâmetros de partida as equações de Van der Waals e dos Gases Ideais tendem a 0% de incerteza. Fizemos um gráfico comparando as duas Equações de estado Fig. 1. O gás utilizado para gerações de dados do gráfico foi o nitrogênio, o mesmo que usaremos no projeto. Concluímos que, tanto a equação de Van der Waals quanto a Equação dos Gases Ideais, utilizadas como base do projeto estão adequadas para os nossos padrões, possibilitando fazer uma comparação bastante precisa entre os valores experimentais – que ainda serão coletados – com os valores teóricos utilizados como base teórica a Equação de Boyle-Mariotte. 5. Referências [1] Determinação da razão de volumes para o método de expansão estática em metrologia de pressão em vácuo, Trabalho de Graduação, Ricardo Cardoso Rangel, Laboratório de Tecnologia do Vácuo – Fatec-SP, 2007. [2] Termodinâmica, Yunus A. Cengel e Michael A. Boles. Agradecimentos Agradecemos à Empresa PV-PrestVácuo Ltda. pela construção de peças do arranjo experimental. 1 Aluno de IC da CNPq.
Baixar