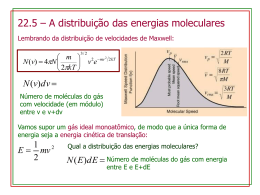
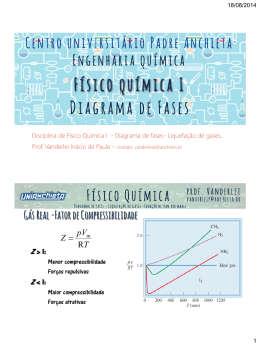
Aula: 04 Temática: Princípio dos Estados Correspondentes Vamos ilustrar mais um conjunto de equações usando uma importante técnica geral em muitas áreas científicas, que é a de usar escalas relativas de grandezas com base numa grandeza que tenha um caráter fundamental. Vimos que as coordenadas críticas são propriedades que caracterizam cada gás e, talvez, possamos estabelecer escalas usando-as como unidade de medida. Desta idéia provêm as variáveis reduzidas de um gás, dadas pelos quocientes entre as coordenadas do gás e a coordenada crítica correspondente: pr = p pc Vr = Vm Vc Tr = T Tc Dada a pressão reduzida do gás, a sua pressão é calculada facilmente pela relação (p = pr × pc). Relações do mesmo tipo são usadas para determinação do volume molar e da temperatura. Van der Waals, que propôs pela primeira vez este procedimento, esperava que os gases confinados no mesmo volume reduzido, Vr e na mesma temperatura reduzida, Tr, tivessem a mesma pressão reduzida, pr. Em grande parte essa expectativa se confirmou. O princípio dos estados correspondentes pode ser enunciado como: gases reais diferentes, em estados com o mesmo volume reduzido, na mesma temperatura reduzida, têm a mesma pressão reduzida. É uma aproximação do comportamento real, mais exata para moléculas esféricas e com falhas para moléculas não-esféricas ou polares. FÍSICO-QUÍMICA Uma sugestão de que as razões que originam as variáveis reduzidas sejam variáveis mais significativas, para a caracterização de um gás, do que as variáveis p, T e Vm, vem da visualização da equação de Van der Waals reescrita pelo uso dos valores de a, b e R em termos de Vc, pc e Tc, como vimos no final da aula passada. 8(T Tc ) p 3 = − pc 3(Vm Vc ) − 1 (Vm Vc )2 Desta maneira temos que: pr = 8Tr 3 − 2 3Vr − 1 Vr O importante desta equação é que ela não contém nenhuma constante que seja peculiar a um gás individual. Assim, ela deve ser capaz de descrever todos os gases. Deste modo, a perda de generalidade da equação de Van der Waals comparada com a equação do gás ideal, foi eliminada. Qualquer equação de estado que envolva apenas duas constantes além de R pode ser escrita apenas em termos das variáveis reduzidas. Por essa razão, equações que envolviam mais que duas constantes foram acusadas de contradizer o princípio dos estados correspondentes, mas, ao mesmo tempo, havia esperanças de que, uma equação precisa para representar dados experimentais com mais de duas constantes, pudesse ser descoberta. Não adiantaria, pois agora se sabe que os dados experimentais não suportam o princípio dos estados correspondentes como postulado de grande precisão, em grandes intervalos de pressão e temperatura. Apesar disto, o princípio é de grande importância na engenharia, para o cálculo no intervalo de pressões e temperaturas industriais. Para finalizar a discussão sobre as equações de estado, é válido saber que a equação de Van der Waals é apenas uma das equações que foram propostas para levar em consideração os dados experimentais p-V-T dos gases. O que é notável é que todas as equações de estado propostas para os gases foram FÍSICO-QUÍMICA baseadas em duas idéias fundamentais sugeridas pela primeira vez por Van der Waals: as moléculas têm tamanho e existem forças atuantes entre elas. Exercícios Propostos: 1. Calcular a pressão exercida por 1,0 mols de C2H6, confinado em cada condição seguinte, na hipótese de: a) Comportamento de gás perfeito (i) A 273,15 K em 22,414 L (ii) A 1000 K em 100 cm3 b) Comportamento de gás de van der Waals (i) A 273,15 K em 22,414 L (ii) A 1000 K em 100 cm3 2. Num processo industrial, o nitrogênio é aquecido a 500 K num recipiente de volume constante igual a 1,0 m3. O gás entra no recipiente a 300 K e 100 atm. A massa do gás é 92,4 kg. Use a equação de Van der Waals para determinar a pressão aproximada do gás na temperatura de operação de 500 K. Para o nitrogênio, a = 1,408 L2 atm mol-2 e b = 3,91 × 10-2 L mol-1. 3. Suponha que 10,0 mols de C2H6 (g) estejam confinados num vaso de 4,860 L a 27 °C. Estime a pressão do etano com: a) A equação dos gases perfeitos. b) A equação de Van der Waals. Com o resultado do cálculo, estime o fator de compressibilidade. Para o etano, a=5,562 L2 atm mol-2 e b=0,06380 L mol-1. Finalizamos aqui as demonstrações relativas às equações de estado. São relações importantes para determinação das propriedades dos gases. FÍSICO-QUÍMICA
Baixar