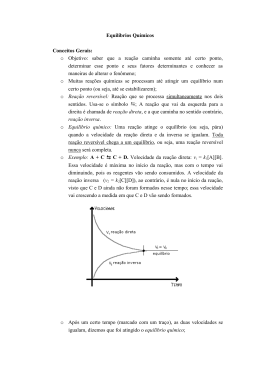
Equilíbrio Químico QF - 10 Reações reversíveis São as reações que ocorrem em ambos os sentidos a todo instante: Equilíbrio químico Quando se tem as concentrações de todos os participantes constantes e nenhum deles foi totalmente consumido. Equilíbrio químico Ex. O CO2 e o H2O reagem segundo a seguinte equação: Como 1 mol de CO e 3 mols de H2 são colocados em um recipiente de 10L a 927 ºC e espera-se que o equilíbrio químico seja atingido, a mistura gasosa contém 0,387 mol de H2O. Qual a composição molar da mistura em equilíbrio químico? t=0 1 mol 3 mols 0 0 t reação -x - 3x x x t equilíbrio 1-x 3 – 3x x x = 0,387 Constante de equilíbrio Relacionar as quantidades de reagente e produtos no equilíbrio. Constante de equilíbrio Se o sistema em equilíbrio apresentar componentes gasosos, a constante de equilíbrio é representada por Kp. OBS 1: Se Kc ou Kp > 1, o valor do denominador é maior que o valor do denominador, ou seja, há mais reagente que produto no equilíbrio; Constante de equilíbrio OBS 2: Se Kc ou Kp < 1, o valor do denominador é maior que o valor do numerador, ou seja, há mais reagente que produto no equilíbrio; OBS 3: O Kc ou Kp depende das concentrações das substâncias no equilíbrio e não das concentrações iniciais dessas substâncias; OBS 4: O Kc e Kp variam com a temperatura t=0 2 mol 0 0 t reação - 2x x X t equilíbrio 2 - 2x X x = 0,442 EX: Em um recipiente de 5,0 L, a 458 ºC, são colocados 4,0 mols de HI. Quando o equilíbrio é alcançado a mistura gasosa contém 0,422 mols de I2. Qual o valor de Kc para a decomposição do HI a 428 ºC? 1 mol 2,5 mols 2 mols 1mol 1V 2,5 V 2V 1V 112 L x y z 280 L 224 L 112 L
Baixar