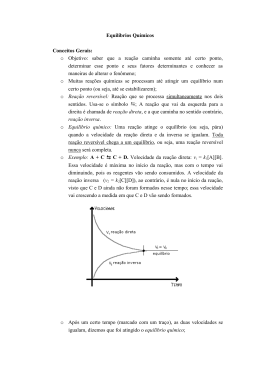
QUÍMICA na abordagem do cotidiano Tema 28 • TITO CANTO Equilíbrio químico e Princípio de Le Chatelier Equilíbrio químico é a situação na qual as concentrações dos participantes da reação não se alteram, pois as reações direta e inversa estão se processando com velocidades iguais. • O valor da constante de equilíbrio (Kc ou Kp) é característico da reação e da temperatura. • O valor da constante de equilíbrio (Kc ou Kp) para uma reação, numa certa temperatura, não depende das concentrações iniciais de reagentes e de produtos. Expressão matemática da constante de equilíbrio em função das concentrações (Kc) aA ⫹ bB F Reagentes Kc ⫽ cC ⫹ dD Produtos [C]c 䡠 [D]d [A]a 䡠 [B]b Expressão matemática da constante de equilíbrio em função das pressões parciais (Kp) aA (g) ⫹ bB (g) F Kp ⫽ cC (g) ⫹ dD (g) (PC )c 䡠 (PD )d (PA )a 䡠 (PB )b Grau de equilíbrio (α) α⫽ quantidade, em mols, que reagiu até atingir o equilíbrio quantidade, em mols, inicial de reagente Espontaneidade de uma reação e valor de Kc 2 SO2 (g) ⫹ O2 (g) F 2 SO3 (g) Kc⫽ 9,9 䡠 10⫹25 N2 (g) ⫹ O2 (g) F 2 NO (g) Kc⫽ 1,0 䡠 10⫺30 Valor relativamente alto O numerador é 9,9 䡠 10 vezes maior que o denominador. No equilíbrio há mais produto do que reagente. 25 Valor relativamente baixo O denominador é 1,0 䡠 10 vezes maior que o numerador. No equilíbrio há mais reagente do que produto. 30 [SO 3 ]2 ⫽ 9,9 䡠 10⫹25 [SO 2]2 䡠 [O 2] [NO]2 ⫽ 1,0 䡠 10⫺30 [N2] 䡠 [O 2] Uma reação é tanto mais favorecida (mais espontânea) a uma certa temperatura quanto maior for o valor de sua constante de equilíbrio nessa temperatura. Princípio de Le Chatelier Quando um sistema em equilíbrio químico é perturbado por uma ação externa, o próprio sistema tende a contrariar a ação que o perturbou, a fim de restabelecer a situação de equilíbrio. Perturbação externa Desloca no sentido de Altera o valor de K? Aumento da concentração da substância Diminuição da concentração da substância Aumento da pressão Diminuição da pressão Aumento da temperatura Diminuição da temperatura Presença de catalisador Consumo dessa substância Formação dessa substância Menor volume gasoso Maior volume gasoso Absorção de calor (endotérmico) Liberação de calor (exotérmico) Não desloca Não Não Não Não Sim Sim Não 1
Baixar