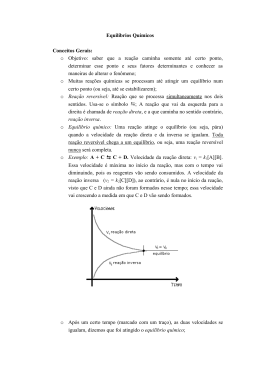
EQUILÍBRIO QUÍMICO Equilíbrio Químico - Equilíbrio químico é a parte da físico-química que estuda as reações reversíveis e as condições para o estabelecimento desta atividade equilibrada. A+B C+D - Qualquer sistema em equilíbrio representa um estado dinâmico no qual dois ou mais processos estão ocorrendo ao mesmo tempo e na mesma velocidade. - As reações da química analítica, as reações na natureza e os principais processos industriais de produção de substâncias são em sua maioria reversíveis, ou seja, desenvolvem-se ao mesmo tempo e em direções opostas. - Assim são, por exemplo, a síntese da amônia e do ácido sulfúrico, a solução saturada de carbonato de cálcio e o equilíbrio do ozônio estratosférico com o oxigênio comum: V1 aA+bB c C+dD V2 - A causa do estabelecimento do equilíbrio químico é a nivelação das velocidades da reação direta (para a direita) e a da inversa (para a esquerda) que se realiza como conseqüência das mudanças de concentração das substâncias. - Duas condições são fundamentais para que se estabeleça o equilíbrio químico: que o sistema esteja fechado e que a temperatura e pressão permaneçam constantes. Características do equilíbrio químico: - A velocidade da reação direta (V1) é igual à velocidade da reação inversa (V2) V1 aA+bB c C+dD V2 V1 = V2 - O equilíbrio é dinâmico: ambas as reações continuam ocorrendo, só que com igual velocidade. O equilíbrio químico é mantido permanentemente pela igualdade das velocidades das reações químicas opostas (microscopicamente tudo continua). O que existe, na verdade, são duas reações opostas que ocorrem com a mesma velocidade. Características do equilíbrio químico: - As propriedades macroscópicas (cor, estado físico, volume, densidade) permanecem constantes, ou seja, externamente não se percebe nenhuma alteração no sistema, apesar de seu caráter dinâmico. - As concentrações de todas as substâncias presentes no equilíbrio permanecem constantes ao longo do tempo. Isto permite caracterizar o equilíbrio por meio de um número, a constante de equilíbrio, que indica a relação das concentrações entre reagentes e produtos. Análise gráfica do equilíbrio: - Podemos construir vários tipos de gráficos, colocando na ordenada a velocidade da reação direta (V1) e indireta (V2), as concentrações de reagentes ou produtos ou ambos, em função do tempo: - Observe nestes gráficos que a concentração do reagente é máxima no início e que diminui com o passar do tempo até ficar constante, enquanto que a concentração do produto é mínima no início e aumenta com o passar do tempo até ficar constante, ou seja, até atingir o equilíbrio. - A situação de equilíbrio em relação às concentrações de reagente e produto pode ser de três tipos: [P]>[R] [R]>[P] O princípio de Le Chatelier: - Em 1888, o químico francês Henri Le Chatelier (1850-1936) lançou uma generalização simples, mas de grande alcance, a respeito do comportamento do sistema em equilíbrio. “Aplicando-se uma perturbação qualquer a um sistema em equilíbrio, o sistema responderá de forma a minimizar o efeito desta perturbação e restaurar o equilíbrio sob um novo conjunto de condições”. - Este princípio se aplica aos fatores que podem deslocar o equilíbrio químico, que são: concentração, temperatura e pressão. Efeito da concentração sobre a Velocidade da Reação e Equilíbrio: - Se em um sistema em equilíbrio se modifica a concentração de uma das substâncias envolvidas, como a velocidade da reação é diretamente proporcional à concentração desta substância, a velocidade num dos sentidos da reação será maior, conseqüentemente, o equilíbrio se desloca para o lado que permitirá que novamente estas velocidades se igualem. Alterando as concentrações das substâncias e mantendo o equilíbrio. Consideremos o efeito da variação de concentração na mistura em equilíbrio cloro e água. A equação de equilíbrio é: Cl2 + 2 H2O HOCl + H3O+ + Cl- Esquerda Direita Esquerda Direita Esquerda Efeito da pressão sobre o Equilíbrio e a Velocidade da Reação: - O fator pressão só interfere no equilíbrio químico que apresenta substâncias gasosas e quando há variação de número de mols entre reagentes e produtos destas substâncias gasosas. Exemplo: N2(g) + 3 H2(g) 1mol 3 mols 2 NH3(g) 2 mols O lado esquerdo da reação representa 4 mols de gás combinando-se para dar 2 mols no lado direito. Um aumento na pressão total do sistema desloca o equilíbrio para a direita. - Quando a reação gasosa se processa sem variação de volume (sem variação de número de mols), a variação de pressão não provoca deslocamento do equilíbrio. Exemplo: N2(g) + O2(g) 2 NO(g) 1mol 1 mol 2 mols Efeito da temperatura sobre o Equilíbrio e a Velocidade da Reação: - As reações químicas ocorrem sempre com variação de calor: temos aquelas que liberam calor (exotérmicas) e aquelas que absorvem calor (endotérmicas). Efeito da temperatura sobre o Equilíbrio e a Velocidade da Reação: O calor pode ser considerado um reagente em reações endotérmicas ou um produto em reações exotérmicas. Portanto, a temperatura é análoga à concentração, ao se aplicar o Princípio de Le Chatelier aos efeitos do calor em uma reação química. Exemplo1: C(s) + CO2(g) + calor 2 CO(g) A reação é endotérmica e, como pode ser visto, o equilíbrio desloca-se para a direita em temperaturas mais elevadas. Exemplo2: PCl3(l) + Cl2(g) PCl5(s) + 88 kJ Neste caso a reação é exotérmica. O calor fará com que o produto PCl5, se decomponha, regenerando o PCl3 e o Cl2. Portanto, o calor desloca o equilíbrio para a esquerda. Constante de Equilíbrio: - Constante de equilíbrio é a constante obtida a partir das concentrações mol/L ou das pressões parciais das substâncias envolvidas no equilíbrio: A B KEq = [ B ] [A] KEq > 1 = [ B ] > [ A ] KEq < 1 = [ A ] > [ B ] Keq varia com a temperatura Exemplos: N2 + 3H2 2NH3 t°C Keq 200 0,4 300 4.10-3 400 2.10-4 1) Escrever a expressão da constante de equilíbrio (Keq) para as seguintes reações genéricas de equilíbrios homogêneos: a) 2A + 3B b) X C + 4D 2Y + M 2) Em determinadas condições de pressão e temperatura, um frasco fechado contém 0,4 mol/L de O3(g) em equilíbrio com 0,2 mol/L de O2(g), de acordo com a seguinte equação: 3 O2 2 O3 Determine o valor de Keq.
Baixar