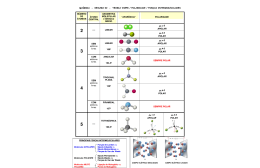
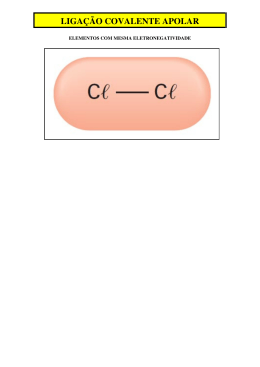
Exercícios de fixação Ligações químicas e geometria molecular 01) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é: a) Halogênios b) Calcogênios c) Metais Alcalinos Terrosos d) Metais Alcalinos e) Gases Nobres 02) (UFF-RJ) Para que um átomo neutro de cálcio se transforme em Ca2+, ele deve: a) receber dois elétrons. b) receber dois prótons. c) perder dois elétrons. d) perder dois prótons. e) perder um próton. 03) Um elemento químico de configuração eletrônica 1s2 2s2 2p6 3s2 3p5 possui forte tendência para: a) perder 5 elétrons. b) perder 1 elétron. c) perder 2 elétrons. d) ganhar 2 elétrons. e) ganhar 1 elétron. 04) Considere as configurações eletrônicas de quatro elementos químicos: I. 1s2 2s2 II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 III. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2 Qual deles apresenta tendência a formar um ânion? a) I. b) II. c) III. d) IV. e) I e II. 05) (Mack-SP) Sabendo que o número de elétrons doados e recebidos deve ser o mesmo e que o cálcio doa dois elétrons e o flúor recebe somente um, então, ao se ligarem entre si átomos de cálcio e flúor, obtemos uma substância cuja fórmula correta é: a) CaF b) Ca2F c) F2 d) CaF2 e) Ca2F2 06) O selênio e o enxofre pertencem à família VI A da tabela periódica. Sendo assim, o seleneto e o sulfeto de hidrogênio são representados, respectivamente pelas fórmulas: a) HSe e HS b) H2Se e HS c) HSe e H2S d) H2Se e H2S e) H3Se e H3S 07)(FUVEST-SP) Considere o elemento cloro formando compostos com, respectivamente, hidrogênio, carbono, sódio e cálcio. (Consulte a tabela periódica.). Com quais desses elementos o cloro forma compostos covalentes? 08) (UNI-RIO) O dióxido de carbono (CO2) é um gás essencial no globo terrestre. Sem a presença desse gás, o globo seria gelado e vazio. Porém, quando ele é inalado em concentração superior a 10%, pode levar o indivíduo à morte por asfixia. Esse gás apresenta em sua molécula um número de ligações covalentes igual a: a) 4 b) 1 c) 2 d) 3 e) 0 09) (U.F. Uberlândia) Na reação de um metal A com um elemento B, obteve-se uma substância de fórmula A2B. O elemento B provavelmente é um: a) Halogênio b) Metal de transição c) Metal Nobre d) Gás raro e) Calcogênio 10) O que é a maleabilidade de uma substancia metálica? 11) Defina o que é o brilho de um metal. 12) Considere as seguintes moléculas: H2 / PCl3 / BH3 / CH4 / CO2. a) Indique as espécies polares. Justifique b) Indique as espécies apolares. Justifique 13) Sobre as seguintes geometrias moleculares, assinale o que for correto 01. O composto CO2 é apolar, porque o vetor µ =0. 02. Os compostos NH3 e H2O são moléculas polares. 04. Os compostos BF3 e CO2 são apolares. 08. Os compostos H2O e BF3 são moléculas polares, pois o vetor µ # 0. 16. Os compostos NH3 e BF3 são moléculas apolares Soma das corretas ( ) 14) Sejam dadas as seguintes moléculas: H2O, BeH2, BCl3 e CCl4. As configurações espaciais dessas moléculas são, respectivamente: a) angular, linear, trigonal, tetraédrica b) angular, trigonal, linear, tetraédrica c) angular, linear, piramidal, tetraédrica d) trigonal, linear, angular, tetraédrica 15) Assinale a alternativa que caracteriza, respectivamente, a polaridade das substâncias dióxido de carbono (CO2), metano (CH4) e tetrafluormeto (CF4). a) APOLAR - APOLAR - APOLAR b) APOLAR - APOLAR - POLAR c) POLAR - APOLAR - POLAR d) POLAR - POLAR - POLAR e) APOLAR - POLAR – POLAR 16) Assinale a alternativa que apresenta APENAS moléculas contendo geometria piramidal. a) BF3 – SO3 – CH4 b) SO3 – PH3 – CHCl3 c) NCl3 – CF2Cl2 – BF3 d) POCl2 – NH3 – CH4 e) PH3 – NCl3 – PHCl2
Download