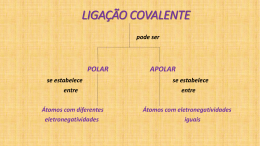
1° ANO – QUÍMICA – LISTA DE EXERCÍCIOS Informação importante: Sempre que necessário, consulte os números atômicos em uma tabela periódica. TODOS OS EXERCICIOS DEVEM CONTER RESOLUÇÃO. ENTREGA DIA: 08/09/2015 PODERÁ SER FEITO EM TRIO. 01 - Para os seguintes átomos: Na, Mg, N, S e F responda: a) Quantos elétrons de valência existem em cada um dos átomos desses elementos? b) Quantos elétrons emparelhados e desemparelhados existem na camada de valência de cada um desses átomos? c) Quantas ligações covalentes (comuns e dativas) cada um desses átomos podem realizar? Justifique. 02 - Monte as fórmulas eletrônica e estrutural (quando houver) para os seguintes compostos químicos. a) HNO3 b) H2O c) CH4 d) H3C-CH2-OH e) H3PO4 f) SO2 g) SO3 h) O3 03 - Monte as fórmulas mínimas para os compostos iônicos formados pela união dos seguintes elementos: a) Na e S b) K e O c) Ba e N d) Al e O e) Cl e P f) Mg e H 04 - Numere a segunda coluna (estruturas geométricas) de acordo com a primeira coluna (compostos químicos). 1. NH3 2. CO2 3. H2O 4. CH4 5. SF6 6. BH3 ( ( ( ( ( ( ) linear ) angular ) piramidal ) tetraédrica ) trigonal plana ) octaédrica 05 - Determine se as seguintes moléculas são polares ou apolares, inclusive as respectivas formas geométricas. a) H2S b) CO2 c) SO2 d) SO3 e) NH3 f) CH4 g) CH2F2 h) PCl5 i) SF6 j) BH3 k) BeH2 l) H2O m) CCl4 n) HCN o) PCl3 p) SiH4 q) N2 r) O2 s) CH2O t) PH3 u) Cl2CO v) HCl x) I2 CH4(g) + 2O2(g) → CO2(g) + 2H2O Em relação ao metano (CH4) e ao dióxido de carbono (CO2), pode-se dizer que a forma geométrica de cada um desses compostos, respectivamente, é a) tetraédrica e trigonal planar. b) tetraédrica e linear. c) quadrática planar e trigonal planar. d) quadrática planar e linear. e) tetraédrica e quadrática planar. 09 - Os gases amônia, dióxido de carbono e trióxido de enxofre são insumos importantes na indústria química. Em relação à polaridade de suas moléculas, é correto afirmar que NH3, CO2 e SO3 são, respectivamente, a) polar, polar e apolar. b) polar, apolar e polar. c) polar, apolar e apolar. d) apolar, polar e apolar. e) apolar, apolar e polar 10 - As interações intermoleculares são muito importantes para as propriedades de várias substâncias. Analise as seguintes comparações, entre a molécula de água, H2O, e de sulfeto de hidrogênio, H2S. (Dados: 1H, 8O, 16S). (00) As moléculas H2O e H2S têm geometrias semelhantes. (01) A molécula H2O é polar e a H2S é apolar, uma vez que a ligação H-O é polar, e a ligação H-S é apolar. (02) Entre moléculas H2O, as ligações de hidrogênio são mais fracas que entre moléculas H2S. (03) As interações dipolo-dipolo entre moléculas H2S são mais intensas que entre moléculas H2O, por causa do maior número atômico do enxofre. (04) Em ambas as moléculas, os átomos centrais apresentam dois pares de elétrons não ligantes 11 - Com relação às moléculas citadas no texto, é correto afirmar: a) As soluções formadas pela dissolução das moléculas de SO2, SO3 e H2SO4 em água conduzem a corrente elétrica. b) A molécula de SO2 é apolar, a molécula de SO3 é polar e a molécula de O2 é polar. c) A molécula de SO2 é linear, a molécula de SO3 é angular e a molécula de H2SO4 é piramidal. d) As moléculas de SO2, SO3 e H2SO4 apresentam 30, 38 e 48 elétrons, respectivamente. e) As ligações entre o átomo de enxofre e os átomos de oxigênio nas moléculas de SO2, SO3 e H2SO4 são covalentes apolares. 06 - As ligações químicas nas substâncias K(s), HCl(g), KCl(s) e Cl2‚(g), são respectivamente: a) metálica, covalente polar, iônica, covalente apolar. b) iônica, covalente polar, metálica, covalente apolar. c) covalente apolar, covalente polar, metálica, covalente apolar. d) metálica, covalente apolar, iônica, covalente polar. e) covalente apolar, covalente polar, iônica, metálica 07 - As substâncias cujas fórmulas são CO2 KI H2O representam, da esquerda para a direita, exemplos de compostos: a) iônico - covalente polar - covalente apolar b) covalente polar - covalente apolar - iônico c) covalente apolar - iônico - covalente polar d) iônico - covalente polar - covalente apolar e) covalente apolar - covalente polar – iônico 08 - A química está na base do desenvolvimento econômico e tecnológico. Da siderurgia à indústria da informática, das artes à construção civil, da agricultura à indústria aeroespacial, não há área ou setor que não utilize em seus processos ou produtos algum insumo de origem química. Um desses insumos é o metano, gás natural, usado como combustível na indústria química. A queima do metano pode ser representada pela seguinte equação: PROFESSORA: ALINE 1
Download