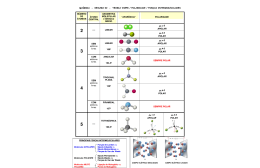
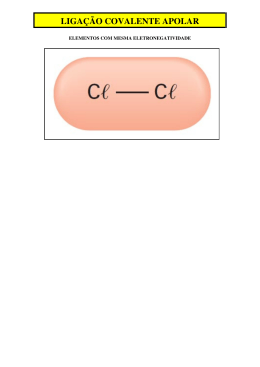
Polaridade das ligações Ao aproximarmos 2 átomos de eletronegatividades s um deles atrairá os e- p/ sí, formando pólos na molécula. Classificação Qualitativa das ligações Ligação de átomos = s apolar Ligação de átomos s polar Obs : alguns átomos têm eletronegatividades =s (N/Cl,I/S/C) formando entre eles lig. apolares. Classificação Quantitativa das ligações Feita pela subtração das eletronegatividades. Se o resultado for: 0 (covalente apolar) Entre 0 e 1,7 (covalente polar) > 1,7 (iônica) Polaridade das moléculas Dada pela soma dos vetores das eletronegatividades dos átomos formadores da molécula. (“momento dipolar”, “”) Cálculo da polaridade da molécula • Verificar a GM da molécula; • Somar os vetores de eletronegatividade de cada ligação; • Se = 0 , molécula apolar Se 0 molécula polar Graças a polaridade molecular , filtros magnéticos diminuem a poluição urbana Forças Intermoleculares Mantêm moléculas unidas nos estados sól. e líq. Há 3 tipos diferentes: 1- Dipolo instantâneo/induzido ( induzido/induzido,forças de London , Van der Waals). Une moléculas apolares , e os gases nobres , é a + fraca das ligações intermoleculares. CO2 2 – Pontes de Hidrogênio (H-FON/FON) Une moléculas polares que possuam ligações entre o”H” c/ “F” ou “O” ou “N”. É a + forte das 3 FI. 3 - Dipolo/dipolo(Dip-dip). Une moléculas polares que ñ tenham “H-FON/FON”. Possui força intermediária. Alterações de estados físicos são causadas pela quebra das F.I. Líq Gás Sól Ligações Intermoleculares Pontes de Hidrogênio Dipolo dipolo Van der Waals Une moléculas Une moleculas Une moléculas apolares polares c/ H-FON polares s/ H-FON É forte É média É fraca Forças intermoleculares e as mudanças de estado físico(PF/PE) PF e PE das substâncias dependem de 2 fatores: - A massa da molécula (Quanto >,> PF e PE) - O tipo de força intermolecular (Quanto >,> PF e PE) Polaridade e solubilidade Geralmente as moléculas seguem a seguinte regra: Polar dissolve polar Apolar dissolve apolar Teste da gasolina c/ água (% de álcool) S/ agitação c/ agitação 50ml H2O + 50ml Gasolina Como isso ocorre ??? O que são os Umectantes? Glicerol Que besteeeeeeeira!!!! Basta olhar pra substância, se é polar ou apolar Pra saber se é solúvel,e a ebulição achar Se é ponte de hidrogênio , se é dipolo ou Van Der Waals Apolares se dissolvem,e também polarpolar Que besteira!!!!!Mas que música rampeira Que besteira !!!!! Se as moléculas se juntam com a mesma ligação No tamanho eu verifico o ponto de Ebulição Classificação das substâncias Substâncias simples Compostas por 1 só tipo de átomo. Substâncias compostas Compostas por + de 1 tipo de átomo. Alotropia Átomos que formam + de 1 tipo de substância simples nas CNTP. Ex: O (O2 e O3) , C (Diamante,Grafite,Carvão) S (Rômbico e Monoclínico) P ( Branco e Vermelho) Estrutura das formas alotrópicas do carbono diamante. fulereno, grafite . Curiosidade As forças intermoleculares numa mistura é ≠ das subst. formadoras da mistura , por isso, frequentemente o volume da mistura é ≠ do volume das substs. separadas. (princípio de não aditividade) + = - = Os pólos são indicados pela letra sigma + ou - H FON
Download