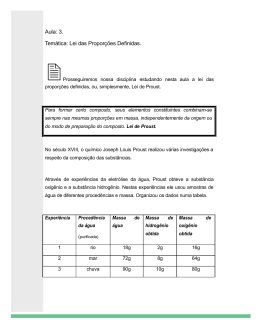
Leis Ponderais e o Modelo Atômico de Dalton Professor: Bruno Santana Lima Alub – Ensino Médio Leis Ponderais das Reações Leis ponderais são leis que falam das massas das substâncias que participam das reações químicas. As principais leis ponderais são: Lei da Conservação das Massas (ou lei de Lavoisier); Lei das Proporções de Massa (ou Lei de Proust). Lei da Conservação da Massa O químico francês Antoine Lavoisier (1743-1794) realizou muitas experiências que levaram à seguinte conclusão: a massa antes e depois de qualquer reação é sempre a mesma. Lei de Lavoisier Experiência Conclusão Carbono + Oxigênio Gás Carbônico 3g 8g 11g “A soma das massas antes da reação é igual à soma das massas após a reação” Veja que: 3g + 8g = 11g Foi observado, porém, que a queima de algumas substâncias havia aumento da massa, enquanto na queima de outras havia diminuição. O grande mérito de Lavoisier foi ter descoberto que essas diferenças de massa se davam por causa da absorção ou liberação de gases durante as reações. Por exemplo, a queima da palha de aço ocorre consumo de oxigênio do ar, o que produz uma substância composta de ferro e oxigênio com massa maior do que a massa da palha de aço. Medindo a massa de palha de aço antes e depois de sua queima, observa-se o aumento da massa do material sólido. Para compreender melhor essa lei podemos esquematizar: Ferro + Oxigênio Óxido de ferro m1 + m2 = m3 Segundo os dados acima a soma da massa das substâncias reagentes é igual à massa das substâncias dos produtos. A Lei de Lavoisier pode ser resumida pela frase: “Na natureza nada se cria, nada se perde; tudo se transforma”. Lei das Proporções de Massa “Uma substância pode ser proveniente de diferentes fontes naturais ou ser obtida por diversos processos. No entanto, seja qual for o método de obtenção, a substância terá sempre a mesma composição química fixa”. Essa foi a conclusão que chegou o químico francês Joseph Louis Proust (1754-1826). Em 1797, Proust enunciou a lei das Proporções Definidas (ou Lei de Proust): “As substâncias reagem sempre na mesma proporção para formarem outra substância.” Lei de Proust Experiência Carbono + Oxigênio Gás Carbônico 3g + 8g 11g ou 6g + 16g 22g ou 9g + 24g 33g Conclusão “A proporção das massas que reagem permanece sempre constante” Modelo Atômico de Dalton Em 1808, John Dalton publicou o livro Novo Sistema de Filosofia química, no qual apresentava sua teoria para a constituição da matéria; Dalton defendia que a matéria era formada por pequenas partículas que ele denominou átomo. Teoria Atômica de Dalton A matéria é constituída por partículas denominadas átomos; As substâncias simples são constituídas por apenas um tipo de átomo (elemento químico) e as substâncias compostas por mais de um tipo de átomo (diferentes elementos químicos); As substâncias compostas são constituídas pela combinação de átomos de diferentes elementos químicos em proporções fixas. Entendendo a relação entre a teoria atômica de Dalton e as leis ponderais. A Lei de Lavoisier é explicada do seguinte modo: Carbono + oxigênio gás carbônico C + O2 CO2 (3g+4g+4g=11g) (4g+3g+4g=11g) Considerando que as partículas (átomos) iniciais e as finais são as mesmas, concluímos que a massa deve permanecer inalterada. A Lei de Proust seria explicada da seguinte maneira: Carbono + oxigênio gás carbônico 1ª Experiência: 2ª Experiência: Da 1ª experiência para a 2ª, a quantidade de átomos dobrou; como conseqüência, todas as massas duplicaram. Substância simples é um tipo de substância formada por átomos de apenas um tipo de elemento químico. Exemplo: H2, O2, N2, He, etc. Substância Composta é um tipo de substância formada por átomos de mais um tipo de elemento químico. Exemplos: H2O, CO2, NaCl, etc.
Baixar