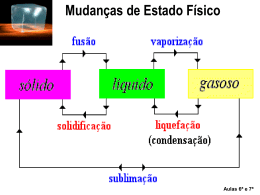
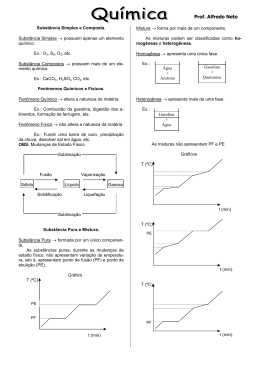
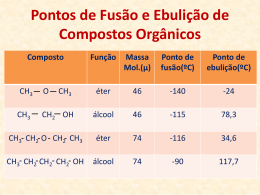
PROF. Márcia Pires Fiuza INTRODUÇÃO AO CONCEITO DE QUÍMICA A química é o ramo da ciência que estuda; •A matéria; •As transformações da matéria; •E a energia envolvida nessas transformações; A seguir temos alguns exemplos de erros cometido ao empregar o conceito de química. Qual o conceito dado a palavra química nesses anúncios? Reescreva-os corretamente. REPRESENTAÇÃO DA MATÉRIA DEMÓCRITOS O filósofo grego que viveu no século IV a.c, sustentou que toda matéria é constituída por partículas pequenas e indivisíveis às quais chamou de átomos e na sua ausência temos o espaço vazio (vácuo), essa idéia entretanto, não prevaleceu e ficou, de certa forma, marginalizada durante mil anos. LEIS PONDERAIS CONSERVAÇÃO DA MASSA (LAVOISIER): Lavoisier verificou que a massa total dos reagentes era igual à massa total dos produtos, essa idéia pode geralmente é resumida com o seguinte enunciado; Na natureza nada se cria, nada se perde tudo se transforma em um sistema fechado. Curiosidade: Lavoisier pertencia à nobreza, graças a um título adquirido por seu pai. Foi um dos principais liberais e racionalistas do Iluminismo. Por estar associado a cobrança de impostos, foi decapitado em 8 de maio de 1794 durante a revolução francesa. PROPORÇÕES FIXAS (PROUST): Proust havia determinado que uma substância sempre apresenta composição constante. 1C + 2 H2 CH4 Se aumentarmos a quantidade de reagente continuaremos a ter o mesmo produto Obs: Se a proporção natural existente entre os reagentes não for respeitada, a reação ocorrerá, entretanto a parte em excesso não será consumida. MODELO ATÔMICO DE JOHN DALTON: Em 1803, John Dalton, tentando explicar o comportamento dos diversos gases da atmosfera e das misturas gasosas, retomou a hipótese atômica. Dalton usou essa hipótese na explicação das leis ponderais da Química, então recentemente formuladas por Lavoisier e Proust. Assim como os filósofos Leucipo e Demócrito, Dalton acreditava que a matéria seria constituída por átomos indivisíveis e espaço vazio. Dalton considerava que; Os átomos são esferas maciças e indivisíveis, Átomos de elementos diferentes apresentam tamanho, massa e propriedades químicas diferentes, Durante a transformação da matéria os átomos são apenas rearranjados. 1 O2 + 2 H2 2 H2O PROPRIEDADES DA MATÉRIA PROPRIEDADES ORGANOLÉPTICAS São propriedades ligadas aos nossos orgãos sensitivos. Cor Cheiro Sabor Textura. PROPRIEDADES FÍSICAS São propriedades relativas à mudanças de temperatura e pressão tal como temperatura de fusão e ebulição, densidade, etc. PROPRIEDADES QUÍMICAS São propriedades que determinam o tipo de fenômeno químico que cada material é capaz de sofrer. SUBSTÂNCIA PURA SUBSTÂNCIA PURA: CORRESPONDE À PARTE DA MATÉRIA QUE APRESENTA APENAS UM COMPONENTE E PROPRIEDADES QUÍMICAS E FÍSICAS DEFINIDAS. CLASSIFICAÇÃO DE SUBSTÂNCIAS SUBSTÂNCIAS SIMPLES: Formadas por um único tipo de elemento e não pode ser decomposta em substâncias mais simples, como exemplos temos; H2, C(grafite), O2, O3, etc. SUBSTÂNCIAS COMPOSTAS: Formadas por dois ou mais tipos de elementos e pode ser decomposta em substâncias mais simples, como exemplo temos; H2O, CO, CO2, HNO3, H2SO4, etc. MISTURA MISTURA: CORRESPONDE À PARTE DA MATÉRIA QUE APRESENTA DOIS OU MAIS COMPONENTES, COMO EXEMPLOS TEMOS; Água mineral Leite CLASSIFICAÇÃO DAS MISTURAS MISTURAS HOMOGÊNEAS: APRESENTAM UMA ÚNICA FASE. MISTURAS HETEROGÊNEAS: APRESENTAM DUAS OU MAIS FASES. CLASSIFICANDO SISTEMAS SISTEMA HOMOGÊNEO SUBSTÂNCIA PURA SUBSTÂNCIA SIMPLES SUBSTÂNCIA COMPOSTA MISTURA HOMOGÊNEA Numa só fase HETEROGÊNEO SUBSTÂNCIA PURA Em fases diferentes MISTURA HETEROGÊNEA Mistura heterogênea constituindo um sistema heterogêneo com seis fases e os componentes gasolina, água, mercúrio, cortiça, pedaços de madeira e latão. Substância pura constituindo um sistema heterogêneo com duas fases e apenas um componente: água nas fases líquida e sólida Nos sistemas abaixo, átomos são representados por esferas. Observe o primeiro item resolvido e preencha as lacunas dos demais 6 moléculas, 2 elementos químicos ( e ) 1 substância(s) composta(s) 1 substância(s) simples (x) mistura ( ) substância pura ESTADOS FÍSICOS sólido líquido vapor PLASMA (Uma pitada de curiosidade) Em física, Plasma é denominado o quarto estado da matéria. Difere-se dos sólidos, líquidos e gasosos por possuir seus átomos separados ao ponto de desprenderem-se dos elétrons. Por este motivo o plasma é também chamado de gás ionizado. Estima-se que 99% de toda matéria existente esteja no estado de plasma, o que faz deste o estado da matéria mais comum e abundante do universo. Um bom exemplo de plasma no nosso planeta é a formação da aurora boreal (pólo norte) ou aurora austral (pólo sul). MUDANÇAS DE ESTADOS FÍSICOS Transformações endotérmicas Há absorção de energia. Transformações exotérmicas Há liberação de energia. energia vapor vaporização líquido energia vapor liquefação líquido solidificação fusão sólido sólido TEMPERATURA DE FUSÃO E EBULIÇÃO TEMPERATURA DE FUSÃO: corresponde a temperatura na qual determinada substância sofre fusão (durante o aquecimento). TEMPERATURA DE EBULIÇÃO: corresponde a temperatura na qual determinada substância sofre ebulição (durante o aquecimento). ESTRUTURA DA MATÉRIA EM DIFERENTES ESTADOS FÍSICOS SÓLIDO LÍQUIDO GASOSO OUTROS MATERIAIS ÁGUA Volume constante Forma constante Baixa energia pot. Volume constante Forma varíavel Média energia pot. Volume variável Forma variável Elevada energia pot. TEMPERATURA DE EBULIÇÃO VERSUS PRESSÃO ATMOSFÉRICA (ÁGUA PURA) Ar rarefeito 73 ◦C 92 ◦C NÍVEL DO MAR PRESSÃO = 1 atm ou 760 mmHg 100 ◦C UMA PITADA DE CURIOSIDADE... Em grandes altitudes é comum ser observado uma formação de gelo que se mantêm relativamente estável, que tal tentarmos entender porque isso é possível !!! PROPRIEDADES FÍSICAS DOS MATERIAIS Pontos de fusão e ebulição Temperatura (oC) Temperatura (oC) ebulição fusão liquefação solidificação Tempo aquecimento Tempo resfriamento AQUECIMENTO DE SUBSTÂNCIA PURA Enquanto a substância permanece em um mesmo estado, o fornecimento de calor faz com que a temperatura aumente (aumenta a energia cinética). Nas mudanças de fase, o calor fornecido é usado para separar as unidades estruturais. Enquanto essa separação estiver ocorrendo, a temperatura permanecerá constante, aumentando somente a energia potencial. Temperatura (oC) L+ V ebulição S+L fusão Tempo(min) AQUECIMENTO DE MISTURA Temperatura (oC) ÁGUA + AÇÚCAR ÁGUA PURA 100 Note que durante a ebulição da água com açúcar a temperatura não permaneceu constante. Tempo Mistura eutética Temperatura (oC) Tempo(min) Mistura azeotrópica Temperatura (oC) Tempo(min) DENSIDADE massa Cortiça (1 cm3) água Ferro (1cm3) volume massa massa m3 Mesma massa m2 m1 v1 v2 v3 volume Mesmo volume volume DESAFIOS: Primeiro desafio- Sabemos que o ferro mais denso do que a água, mesmo sendo água do mar; então, como pode uma embarcação feita de aço flutuar? Segundo desafio- Como é possível uma lâmina metálica flutuar ao ser colocada na horizontal em relação ao líquido e afunda ao ser colocada perpendicular? Terceiro desafio- Essa é para responder o mais rápido possível; quem tem maior massa 1 Kg de FERRO ou 1 kg de ISOPOR? Quarto desafio- Leia a frase a seguir, INDIQUE se ela está CERTA ou ERRADA e JUSTIFIQUE sua indicação. “A água no mar têm densidade maior do que a água pura”.
Baixar