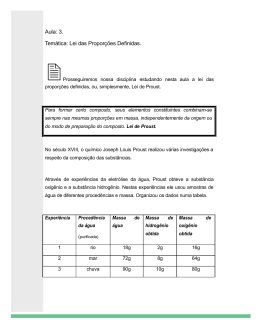
Reações Químicas Prof. Júlio César O que são Reações Químicas? É a transformação da matéria, na qual ocorrem mudanças qualitativas na composição química de uma ou mais reagentes, resultando em um ou mais produtos. Leis Ponderais das Reações Leis ponderais são leis que falam das massas das substâncias que participam das reações químicas. As principais leis ponderais são: Lei da Conservação das Massas (ou lei de Lavoisier); Lei das Proporções de Massa (ou Lei de Proust). Lei da Conservação da Massa O químico francês Antoine Lavoisier (17431794) realizou muitas experiências que levaram à seguinte conclusão: a massa antes e depois de qualquer reação é sempre a mesma. Em 1797, Proust enunciou a lei das Proporções Definidas (ou Lei de Proust): “As substâncias reagem sempre na mesma proporção para formarem outra substância.” Lei de Proust Experiência Carbono + Oxigênio Gás Carbônico 3g + 8g 11g ou 6g + 16g 22g ou 9g + 24g 33g Conclusão “A proporção das massas que reagem permanece sempre constante” As reações químicas costumam ocorrer acompanhadas de alguns efeitos que podem dar uma dica de que elas estão acontecendo: QUAIS SÃO ESSES EFEITOS? ??????????????????????????? SAÍDA DE GASES. FORMAÇÃO DE PRECIPITADO. MUDANÇA DE COR. ALTERAÇÕES DE CALOR. Tipos de Reações Químicas • Reações de síntese; • Reações de decomposição; • Reações de simples troca; • Reações de dupla troca; Reações de Síntese • Conhecidas como reações de composição ou de adição. Reações de Decomposição • Ocorrem quando a partir de um único composto são obtidos outros compostos. Reações de deslocamento Escala de reatividade de metais Li,K,Rb,Cs,Ba,Sr,Ca,Na,Mg,Al,Mn,Zn,Fe,Co,Ni,Pb,H,Cu,Ag,Pd,Pt,Au Exemplos: a) Zn(s) + CuSO4 → b) Al(g) + HCl(aq) → c) Au(s) + HCl(aq) → Reações de deslocamento • Escala de reatividade dos ametais F, O, Cl, Br, I ,S , C, Se, P, H, Te, Ar , B, Si Exemplos: a) Cl2(aq) + KI(aq) → b) I2(s) + NaCl(s) → c) Cl2(g) + NaBr(s) → Reações de dupla troca Produto menos ionizado: é o produto menos dissociado, ou seja, mais fraco. A Neutralização é um exemplo de reação que dá origem a esse tipo de produto: HCl(aq) + NaOH(aq) → Produto mais volátil: a reação se caracteriza pela formação de um gás. NaCl(s) + H2SO4(aq) → Produto Insolúvel Pb (NO3)2 (aq) + NaI(aq) → Liberação de gás Na2CO3(s) + HCl →
Baixar