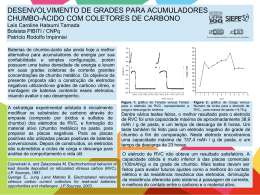
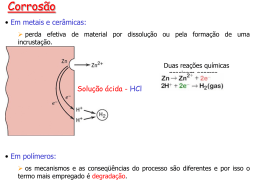
O que é corrosão Corrosão é a degradação espontânea, indesejada, de um material exposto a certo meio, por ação química (direta) ou eletroquímica (indireta). A maioria dos metais são encontrados na natureza na forma de compostos estáveis como óxidos, sulfetos, silicatos etc. . denominados minérios. Durante o processo de extração e refino, e´ adicionada uma quantidade de energia ao minério para extrair o metal ou metais nele contidos. É esta mesma energia que possibilita o aparecimento de forças capazes de reverter o metal `a sua forma primitiva de composto mais estável. Metal + oxidante compostos metálicos + energia Corrosão Tipos de corrosão 1. 2. 3. 4. 5. 6. 7. 8. Corrosão Uniforme Corrosão por Pites Corrosão por Concentração Diferencial Corrosão Galvânica Corrosão Seletiva Corrosão associada ao escoamento de Fluidos Corrosão Intergranular Fissuração por Corrosão Corrosão Galvânica É provavelmente o tipo mais comum. • A associação de dois eletrodos dá-se o nome de pilha ou célula galvânica ou elemento de pilha. • Nas pilhas, aproveitam-se as reações de oxi-redução (transferência de elétrons) para produzir corrente elétrica. • Uma pilha é formada por 2 ou mais eletrodos (placa de metal mergulhada numa solução contendo cátions desse metal) unidos por uma ponte salina (permite uma corrente de íons) e um condutor (permite uma corrente de elétrons). Nomenclatura eletroquímica A nomenclatura adotada atualmente no estudo da eletroquímica, eletrólise, corrosão e engenharia eletroquímica é derivada da criada por Faraday. A seguir está descrita a nomenclatura hoje utilizada no estudo da eletroquímica a) ELETRODOS: São assim chamadas as partes metálicas que estão em contato com a solução dentro de uma célula eletroquímica. b) ÂNODOS: São os eletrodos pelo qual a corrente elétrica que circula numa célula ENTRA na solução. c) CÁTODOS: São os eletrodos pelo qual a corrente elétrica que circula numa célula DEIXA a solução. Nomenclatura eletroquímica OBS. Lembrando que o sentido convencionalmente adotado para a corrente elétrica é o sentido oposto ao da movimentação dos elétrons, ânodo e cátodo podem ser redefinidos como segue: ÂNODO: Eletrodo do qual saem os elétrons para o circuito externo da célula. CÁTODO: Eletrodo no qual entram os elétrons através do circuito externo da célula. d) ELETRÓLITOS: São assim chamadas todas as soluções que CONDUZEM a corrente elétrica. e) ÍONS: São assim chamadas as partículas carregadas que se movimentam na solução. OBS. A palavra íon provém da literatura grega e significa viajante. Nomenclatura eletroquímica f) CÁTIONS: São os íons com carga POSITIVA. g) ÂNIONS: São os íons com carga NEGATIVA. OBS. Os íons são diferentes dos elétrons porque sua massa não é desprezível. Assim, uma movimentação de íons além de movimentação de carga é também uma movimentação de massa. h) CÉLULA ELETROQUÍMICA: Todo sistema formado por um circuito externo que conduza a corrente elétrica e interligue dois eletrodos que estejam separados e mergulhados num eletrólito. Célula Eletroquímica O fenômeno pode ser visto no modelo de uma célula galvânica conforme Fig 1 ao lado. Célula Eletroquímica No eletrodo de Zn ocorre a seguinte reação: No eletrodo de Cu ocorre a seguinte reação: Reação Global: Célula Eletroquímica e- e- Ponte Salina (KCl sat.) Eletrodo de Cobre Eletrodo de Prata [Cu2+] = 1.00 mol/L Cu(s) [Ag+] = 1.00 mol/L Cu2+ + 2e- Ânodo (oxidação) Ag+ + e- Ag(s) Cátodo (redução) Componentes de uma Célula Eletroquímica • 2 condutores imersos em uma solução contendo eletrólitos (eletrodos) • 1 condutor eletrônico externo para permitir o fluxo de elétrons • 1 condutor iônico para evitar o contato direto dos reagentes e permitir o fluxo de íons Célula Eletroquímica – Movimento de cargas eee- e- e- Oxidação Redução e- Cu2+ NO3 2- Ag+ SO4 eee- Cu2+ NO3 2- SO4 Cu2+ Cl- CuSO4 Interface Eletrodo/solução K+ K+ AgNO3 Cl- e-ee- Ag+ NO3 e- Interface Eletrodo/solução Diferença de potencial de uma pilha O valor da diferença de potencial de uma pilha pode ser obtido por um voltímetro, que deve ser instalado entre os dois eletrodos da pilha, porque cada eletrodo tem um potencial, os elétrons fluem devido a diferença de potenciais de cada eletrodo. A maior valor de diferença de potencial que se pode obter de uma pilha galvânica é chamado de força eletromotriz . O eletrodo em estudo fornece elétrons ao eletrodo padrão de hidrogênio, seu potencial será indicado com sinal positivo. O eletrodo em estudo recebe elétrons do eletrodo padrão de hidrogênio, seu potencial será indicado com sinal negativo. Procedimento experimental Montar as pilhas Zn (s) | ZnSO4(aq) | | CuSO4(aq)|Cu(s) Zn(s) | NaCl(aq) | | NaCl(aq)|Cu(s) Fe(s) | NaCl(aq) | | NaCl(aq)|Cu(s) Utilizar cubas eletrolíticas (beckers) e introduzir em seu interior cerca de 2/3 do volume total, a solução indicada em cada caso. Prender o par de placas correspondente a cada pilha as garras de fixação da cuba (jacaré) As placas devem permanecer fixas, paralelas, separadas uma das outras por certa distancia e apenas parcialmente submersas , ficando suas partes posteriores acima da solução. Procedimento experimental E verificar: ddp lida Testar a lâmpada Verificar o sinal da ddp Reconhecimento do eletrodo Funcionamento da pilha Calcular a força eletrometriz Organiza-se uma tabela de potenciais – padrão de redução Sendo que: Os eletrodos que fornecem elétrons (ânodo) são colocados acima do hidrogênio, ficando com o sinal negativo. Os eletrodos que recebem elétrons (cátodo) são colocados abaixo do hidrogênio, ficando com o sinal positivo. Procedimento experimental - Observações Pela reação global, percebe-se que a placa de Zn sofre corrosão e ainda ocorre um aumento da concentração de Zn2+ na solução. • No eletrodo de cobre, íons Cu2+ recebem os elétrons cedidos pelo Zn e se transformam em Cu, que é depositado na placa de Cu, diminuindo a concentração de Cu2+ na solução. • Para manter o equilíbrio elétrico de cargas positivas e negativas na solução, íons Zn2+ migram para o eletrodo de Cu e íons Cu2+ migram para o eletrodo de Zn, através da ponte salina. Obs: O eletrodo que sofre redução é chamado de cátodo (pólo positivo) e o eletrodo que sofre oxidação é chamado de ânodo (pólo negativo). Ered do cátodo é sempre maior que a Ered do ânodo. O sentido da corrente elétrica que passa pelo condutor é do ânodo para o cátodo. Procedimento experimental - Observações MATERIAIS E REAGENTES • Solução de cloreto de sodio (NaCl) 3%; · Solução de sulfato de cobre (CuSO4) 1 mol/L; · Solução de sulfato de zinco (ZnSO4) 1 mol/L; · Solução de cloreto de potássio (KCl) saturada · 3 béquers de 100 mL · Palha de aço · Placas de cobre (Cu) · Placa de zinco (Zn) · Placa de Ferro (Fe) · Fios com jacaré · Tubo em forma de U Potenciais - padrão de eletrodo
Download