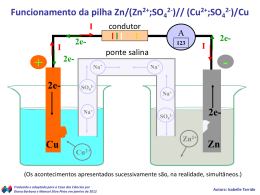
ELETROQUÍMICA Eletroquímica é a área da Química que estuda as interfaces carregadas eletricamente e os fenômenos que ocorrem nestas interfaces. As interfaces consideradas são superfícies de separação entre um condutor eletrônico e um condutor iônico. ELETROQUÍMICA O sistema formado por um condutor eletrônico e um condutor iônico postos em contato é denominado Eletrodo. ELETROQUÍMICA De um modo geral, o condutor eletrônico é um metal e o condutor iônico é uma solução eletrolítica ou um sal (iônico) fundido. ELETROQUÍMICA Em 1836, John Frederick Daniell, químico inglês, construiu um dispositivo (mais tarde chamado pilha), que permitia aproveitar o fluxo de elétrons, interligando eletrodos que eram sistemas constituídos por um metal imerso em uma solução de seus íons. ELETROQUÍMICA ELETROQUÍMICA O zinco é mais reativo que o cobre, logo, tende a doar seus elétrons ao cátion cobre. Ao fechar-se o circuito, haverá passagem de elétrons do zinco para o cobre. A placa de zinco começa a se corroer, enquanto a placa de cobre aumenta de tamanho e a solução azul de Cu2+ começa a diminuir a intensidade da cor. ELETROQUÍMICA Começa o processo de OXIDAÇÃO (perda de elétrons) dos átomos de zinco que constituem a placa. Cada átomo superficial de zinco perde 2 elétrons e se transforma em Zn2+. Esse eletrodo é chamado de ÂNODO(-). Zn0 2e- + Zn2+ ELETROQUÍMICA No eletrodo de cobre ocorre o processo de REDUÇÃO (ganho de elétrons). Na placa de cobre, imersa numa solução de Cu2+, estão chegando os elétrons liberados na oxidação do zinco. Esse eletrodo é chamado de CÁTODO (+). Cu2+ + 2e- Cu0 ELETROQUÍMICA Após algum tempo, o eletrodo de zinco irá se dissolver provocando aumento da concentração de Zn2+ na solução. Por outro lado, no eletrodo de cobre haverá deposição de cobre metálico diminuindo consideravelmente a concentração de Cu2+ na solução. ELETROQUÍMICA ELETROQUÍMICA Função da PONTE SALINA Ela é constituída de um tubo em U, preenchido com algodão embebido em uma solução qualquer. Ela tem a função de permitir a migração de íons de uma solução para outra, de modo que o número de íons positivos e negativos na solução de cada eletrodo permaneça em equilíbrio. ELETROQUÍMICA ELETROQUÍMICA Cálculo da ddp das pilhas (voltagem): Zn0 2e- + Zn2+ E0= +0,76 V Cu2+ + 2e- Cu0 E0= +0,34 V E = E0oxid + E0red = + 1,10 V ou E = E0redmaior - E0redmenor = 0,34 - (-0,76)=1,10V ELETROQUÍMICA A equação global dos processos envolvidos nessa pilha será: ânodo: Zn0(s) 2e- + Zn2+(aq) E0= +0,76 V cátodo: Cu2+(aq) + 2e- Cu0(s) E0= +0,34 V reação global: Zn0(s) + Cu2+(aq) Zn2+(aq) + Cu0(s) ELETROQUÍMICA Essa pilha pode ser representada por: Zn0(s) / Cu2+(aq) // Zn2+(aq) / Cu0(s)
Baixar