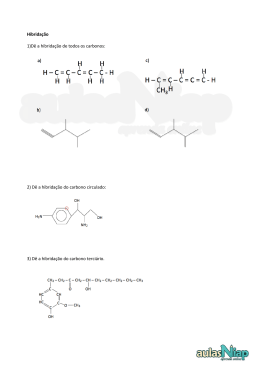
Fevereiro 2011 Química A- 12º ano Turma A ES C OL A S E CUN D ÁR I A C /3 º C EB D E RI O T IN TO Unidade 2: Combustíveis, energia e ambiente- Teoria das ligações de PROFESSOR: Miguel Viveiros valência Núcleo de Estágio (FV/MS) Ficha formativa “Saber mais Química- 12” 1. Em que consiste a teoria da ligação de valência (TLV)? 2. Determine o estado de hibridação do átomo central (sublinhado) de cada uma das seguintes moléculas: a) BCl3 b) BeF2 c) CF4 Descreva o processo de hibridação e determine a geometria da molécula em cada um dos casos. 3. Utilize a teoria da ligação de valência para explicar as ligações químicas nas moléculas de Cl2 e de HCl. 4. Explicite as diferenças entre uma orbital híbrida e uma orbital atómica pura. 5. É possivel que duas orbitais 2p de um átomo se combinem para dar origem a duas orbitais híbridas? Fundamente a sua resposta 6. Como se destingue uma ligação sigma, σ, de uma ligação pi, π? 7. Considere os seguintes pares de orbitais atómicas pertencentes a núcleos adjacentes: a) 1s e 1s; b) 1s e 2px ; c) 2px e 2py; d) 3py e 3py; e) 2px e 2px f) 1s e 2s 7.1. Refira os pares que podem coalescer e formar uma ligação σ. 7.2. Refira os pares que podem coalescer e formar uma ligação π. 7.3. Quais não podem coalescer (não há formação de qualquer ligação)? 8. A molécula de HCN tem geometria linear. Usando a teoria da ligação de valência explique a estrutura da molécula. 1 “Saber mais Química-12”
Baixar