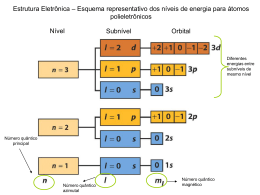
DEPARTAMENTO DE CIÊNCIAS EXPERIMENTAIS DISCIPLINA: Física e Química - A FICHA DE CONTROLO 4 : Orbitais e números quânticos ESCOLA SECUNDÁRIA COM 2º E 3º CICLOS ANSELMO DE ANDRADE ANO LECTIVO 2010/11 Nome - __________________________________________Nº - ______ T - ______ Professor: Dulce Campos 1. Relacione os dados sobre os modelos atómicos na coluna I com os respectivos autores da coluna II. COLUNA I COLUNA II 1. Electrões descrevendo órbitas A. Schrodinger 2. Átomo planetário B. Dalton 3. Modelo matemático C. Bohr 4. Esfera compacta D. Rutherford 2. Assinale a opção correcta. O modelo de Bohr estava errado ao afirmar que: A. Num átomo de hidrogénio, no estado fundamental, os electrões não perdem energia. B. O átomo contém um núcleo. C. O electrão, quando recebe energia, pode saltar para uma camada mais externa. D. Os electrões deslocam-se em órbitas circulares em redor do núcleo. E. Um átomo só pode ganhar energia em quantidades equivalentes a um múltiplo inteiro de uma quantidade mínima chamada quanto. 3. Por que razão se «abandonou» a noção de órbita do modelo de Bohr? 4. Os números quânticos n, l e ml estão ligados, respectivamente, ao conceito de: A. Tamanho, orientação da orbital e rotação do electrão. B. Tamanho, forma e orientação da orbital. C. Rotação do electrão, forma e tamanho da orbital. D. Forma, tamanho da orbital e rotação do electrão. Escolha a opção correcta. 5. Classifique cada uma das afirmações que se seguem como verdadeira ou falsa, corrigindo as falsas. A. O número quântico principal n relaciona-se com o tamanho da orbital e pode assumir os valores inteiros 1, 2, 3, ….. B. O número quântico azimutal relaciona-se com o tipo de orbital e pode assumir qualquer valor inteiro de 0 a n (inclusive). C. O número quântico magnético relaciona-se com a orientação da orbital no espaço e varia de –l a +l. D. O número quântico de spin distingue os dois electrões na mesma orbital e pode assumir os valores + ½ e–½. 10º ANO 6. Considere as orbitais 1s, 2s, 2px, 2py e 2pz do átomo de hidrogénio. De entre as afirmações que se referem ao átomo de hidrogénio, seleccione a correcta: A. Quando o electrão se encontra em qualquer uma das orbitais referidas, o átomo encontra-se no estado excitado. B. Quando o electrão transita da orbital 2px para a orbital 2py, há absorção de energia. C. Quando o electrão transita de uma orbital 2s para uma orbital 2px, há absorção de energia. D. As orbitais de número quântico principal n=2 têm todas a mesma energia. E. Quando sobre um átomo de hidrogénio incide uma radiação, esta é sempre absorvida, provocando uma transição electrónica. F. A sequência dos tamanhos das orbitais referidas é: 1s < 2s < 2px < 2py < 2pz. 7. Indique o conjunto de números quânticos que caracterizam a orbital 5s. 8. Qual é a orbital caracterizada pelos três números quânticos (4, 2 e 0)? 9. Indique um conjunto possível de números quânticos para a orbital 3d. 10. Considere os dois electrões da orbital 3s. Indique os números quânticos que caracterizam estes electrões. 11. Um electrão num dado átomo está no nível quântico n=2. Escreva os valores de l e ml que ele pode ter. 12. Considere as seguintes orbitais: 3s, 2p, 3d. Indique os conjuntos possíveis de números quânticos associados a cada uma destas orbitais. 13. Coloque por ordem crescente de tamanho as seguintes orbitais: 1s de 1 H , 1s de 2 H+ e 1s de 3Li2+ . 14. Considere os conjuntos de números quânticos presentes no quadro abaixo. A B C D E n 3 2 4 4 5 l 0 2 3 3 2 ml 0 1 3 -1 -3 14.1. Indique os conjuntos que não têm possibilidade de existir, justificando a sua opção. 14.2. Que orbitais identificam os restantes conjuntos de números quânticos? BOM TRABALHO!!
Baixar