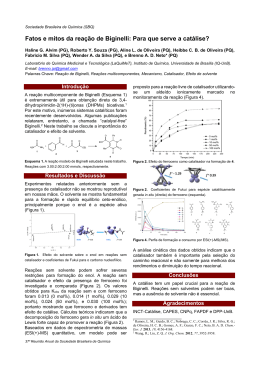
Fatores que alteram a velocidade de uma reação química Catalisador Substância que no meio reacional acelera a reação química, proporcionando um novo mecanismo para os reagentes, com uma energia de ativação menor. Todo catalisador possui em comum as seguintes características: Não sofre alteração permanente na sua massa ou na sua composição (é integralmente recuperado no final da reação). A ação catalítica só é possível quando existe afinidade química entre os reagentes. Se a reação for reversível, os produtos reagem entre si, formando novamente os reagentes, o catalisador acelera a reação direta e inversa ao mesmo tempo. Catálise Processo em que se utiliza um catalisador na reação química. • Catálise homogênea: Quando o catalisador e os reagentes formam um sistema monofásico. Exemplo: na combustão do SO2 para formar SO3 catalisada pelo NO2: 2 SO2 + O2 → 2 SO3 REAÇÃO LENTA A reação é lenta, mas na presença de NO2 é bastante rápida. Catalisador Etapa I: 2 SO2 + 2 NO2 → 2 SO3 + 2 NO Etapa II: 2 NO + O2 → 2 NO2 Global : 2 SO2 + O2 → 2 SO3 Catalisador • Catálise heterogênea: Quando o catalisador forma com os reagentes um sistema polifásico. Exemplo: na combustão do SO2 para formar SO3 catalisada pelo pentóxido de divanádio (sólido). 2 SO2 + O2 → 2 SO3 Esquema de ocorrência daMolécula catálise heterogênea reagente, O , em contato com o catalisador 1) sólido, V2O5. 2 2) O2 adsorvido no catalisador. 3) Átomos de oxigênio nascente, [O],formados no catalisador. 4) Ataque do oxigênio nascente à molécula de dióxido de enxofre, SO2. 5) Molécula de SO3 formada. Outro exemplo de catálise heterogênea é a que ocorre nos conversores catalíticos de automóveis. São substâncias utilizadas para diminuir a velocidade de uma reação, agindo de modo inverso aos catalisadores. Eles aumentam a energia de ativação, necessária para formação do complexo ativado. São importantes para controle e estudo de reações muito rápidas. A função principal do inibidores está relacionada à ação conservante de produtos perecíveis. Diagramas com catalisador PROD Eacat Ea ∆H REAG Questões 1. Algumas ações do nosso dia a dia confirmam os parâmetros e as variáveis que governam as reações químicas. Analise as afirmativas a seguir, que se referem a algumas dessas ações: I. Um comprimido efervescente reage mais rapidamente com a água se for colocado inteiro porque sua superfície de contato é maior do que se fosse triturado. II. O processo de deterioração de um quilo de carne de boi envolvida em plástico será mais lento se a peça inteira for colocada em um freezer do que se a carne for fatiada e envolvida individualmente em plástico no mesmo freezer. III. Na despressurização de um avião voando a grande altitude, a atmosfera interna torna-se mais rica em oxigênio, aumentando a rapidez das reações de combustão. IV. A cabeça do palito de fósforo, com um ligeiro atrito em uma superfície áspera, entra em combustão em um processo exotérmico. Assinale a alternativa correta. a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas II e IV são corretas. c) Somente as afirmativas III e IV são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas I, III e IV são corretas. 2. Em determinadas condições a reação de formação da amônia (NH3) ocorre com o consumo de 24 mols de nitrogênio em 240 segundos. Sabendo que essa reação é representada pela equação: N2(g) + 3H2(g) 2NH3(g) Podemos afirmar que a velocidade de consumo do hidrogênio em mol/min é: a) 12 mol/min b) 24 mol/min c) 6 mol/min d) 0,1 mol/min e) 18 mol/min Fim!
Baixar


![V = k . [reagente]coeficiente](http://s1.livrozilla.com/store/data/000708237_1-04b0a24e45ff78b3cc4dbb36f01b4d4c-260x520.png)