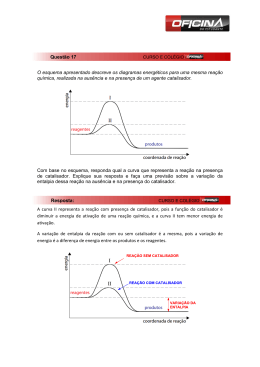
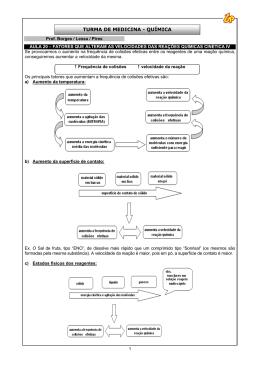
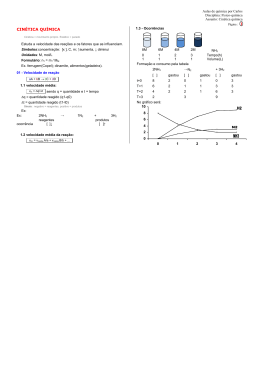
Cinética Química Autor: Bernardo Maia Cinética Química Esse é a parte da química onde é estudado a velocidade das reações e os fatores que podem alterá-la, contribuindo para que seja mais rápida ou mais devagar. Cinética Química Primeiramente vamos pensar: As reações ocorrem sozinhas ou necessitam de algo para ocorrerem ? Energia Cinética As reações necessitam de energia para que aconteçam. Essa energia é chamada de energia de ativação ( Eat). Essa energia pode ser fornecida de diversas formas como calor, atrito dentre outras. Gráfico Energia de Ativação Nos gráficos, a energia de ativação é representada pela diferença entre os reagentes e o topo da curva. Quando essa energia é fornecida para os reagentes( onde ocorre a reação), eles se agitam de formam que o complexo ativado apareça, que é o momento da reação de maior energia. Complexo Ativado No complexo ativado, os reagentes estão com as ligações rompidas e ocorre a colisão efetiva, que consiste na real formação do produto. Gráfico No gráfico ao lado podemos localizar: I – Energia do complexo ativado II – Energia de ativação III –Entalpia dos reagentes IV- Entalpia dos produtos V- Entalpia da reação A reações podem ocorrer em apenas uma etapa, sendo chamada de reação elementar ou em mais de uma etapa chamada de nãoelementar. Como dito anteriormente, a reação ocorre nos reagentes. A fórmula da velocidade das reações consiste na multiplicação das concentrações dos reagentes elevadas a seus coeficientes, multiplicados por uma constante. Apenas os compostos aquosos e gasosos participarão da fórmula da velocidade da reação não sendo utilizados os sólidos e os líquidos. Tipos de reação 1. Reação elementar ( genérica) A ( s) + 2B ( g) + C ( aq) E ( aq) 2. Reação não- elementar A ( s) + C ( aq) E ( aq) Etapa rápida E(aq) + D (s) F (aq) Etapa lenta As reações não elementares, possuem sempre uma etapa lenta e as demais são rápidas. Essa etapa será a determinante da velocidade das reações, sendo esta a utilizada na fórmula. • Exemplo da velocidade da reação: Serão utilizadas reações elementares e não elementares já citadas.( Volte ao slide tipo de reação) Elementar: V=K[B]2[C] Não -elementar: V=K[E] Gráfico reação não-elementar Nos gráficos de reações não elementares temos a presença de mais de uma curva, sendo a de maior energia de ativação a etapa lenta. No gráfico temos a presença de duas etapas, sendo a mais lenta a etapa II por ter maior Eat Fatores que alteram velocidade da reação Alguns fatores alteram a velocidade da reação, sendo eles: • Concentração • Temperatura • Superfície de contato • Catalisador/ Inibidor • Pressão Vamos pensar: • Como a concentração pode afetar na velocidade da reação? Veja a imagem abaixo: Existe uma grande chance das pessoas se esbarrarem neste local ou num local mais vazio? Assim como num ambiente com muitas pessoas é provável que elas se esbarrem,isso também ocorre com os reagentes de uma reação. Quanto maior a concentração dos reagentes, maior o número de choques entre eles e consequentemente maior a quantidade de produto formado, sendo mais rápida a reação. Ilustração do efeito da concentração Na ilustração ao lado podemos perceber que quando a concentração aumenta, as colisões moleculares também aumentam. • Temperatura: • Como a temperatura poderia alterar na velocidade das reações? • Vejamos a figura: Na figura temos a imagem de uma água em ebulição. Nesse momento as moléculas se encontram agitadas o que irá contribuir para um choque mais rápido dos reagentes, ocorrendo mais rapidamente a reação. Superfície de contato: • A superfície de contato está relacionada à superfície exposta para reagir. Se a superfície aumenta, a reação ocorrerá mais rapidamente. Na imagem ao lado temos a presença de uma roda onde está com formação de ferrugem. Essa reação ocorre devido ao contato do metal com o oxigênio. • Para Pensar: Como fazemos para manter as rodas e latarias do carro sem sofrer o processo de enferrujamento? Catalisador/ Inibidor O catalisador tem a função de acelerar uma reação diminuindo a energia de ativação da reação. No gráfico ao lado a curva azul representa a reação sem catalisador. Ao adicionarmos o catalisador, a energia de ativação diminui representada pela linha vermelha. • O inibidor tem a função de retardar a reação, fazendo com que necessite de uma maior energia de ativação para ocorrer. • Exemplo: os conservantes de alimentos têm a função de inibir o processo de uma reação que possa causar alteração no alimento. O catalisador dos carros O catalisador dos carros, lançado em 1992 como item obrigatório nos veículos, tinha a função de fazer com que a queima da gasolina fosse completa de forma que liberasse o dióxido de carbono ( CO2) e não o monóxido ce carbono ( CO) gás muito mais nocivo que o CO2. • Veja a ilustração de um catalisador O CO é transformado em CO2 para se tornar menos poluente. http://www.carroecia.com.br/reportagens/especial/cuidados.asp • Pressão: Para finalizar os fatores que alteram a velocidade da reação, temos a pressão que, que só afetam os gasosos. Quando diminuímos o volume de onde o gás se encontra, aumentamos a pressão do gás que passa a ter suas moléculas mais próximas favorecendo a reação Atividades propostas 1. • • • Faça algumas experimentações rápidas para ilustrar os fatores que alteram o equilíbrio, e peça ao aluno que explique o que ocorre. Jogue sobre um pedaço de batata algumas gotas de água oxigenada. Aqueça um pouco de água e coloque em um copo. Em outro recipiente, coloque água gelada ou à temperatura ambiente. Jogue um comprimido efervescente de mesmo tamanho em cada copo e acompanhe o tempo de dissolução. Coloque água à temperatura ambiente em dois copos. Pegue dois comprimidos efervescentes e tritura um deles. Joguem nos copos e observe o tempo de dissolução. 2. Dê três exemplos de superfície de contato e concentração de situações cotidianas que alterem a velocidade de alguma reação.
Baixar