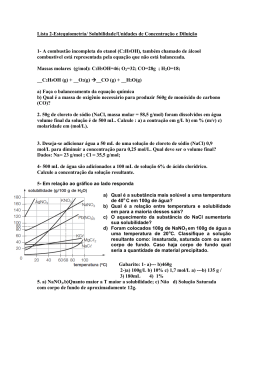
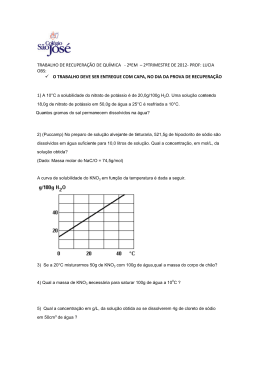
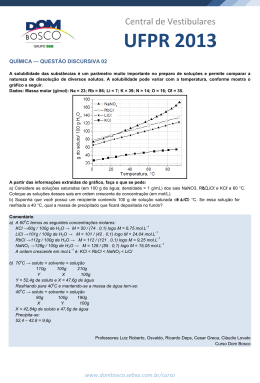
ATIVIDADE DE QUÍMICA NOME: PROFESSOR: Weasley Martins DATA: 01. O gráfico a seguir expressa as diferentes solubilidades de dois sais distintos, KNO3 e NaCl , em função da temperatura: a) ( b) ( c) ( d) ( e) ( ) 30 ) 50. ) 150. ) 180. ) 190. 03. Considere o dado a seguir: Com base no gráfico apresentado, apresentamse as seguintes afirmativas: I. A 25°C, a solubilidade de ambos os sais é a mesma. II. A solubilidade do KNO3 praticamente não varia em função da temperatura. III. Dissolvendo-se 50g de KNO3 , em 100g de H2O, a 30°C, obtém-se uma solução saturada. IV. A dissolução do NaCl em água é exotérmica. Estão corretas apenas as afirmativas a) ( ) I e II. b) ( ) I e III. c) ( ) II e III. d) ( ) II e IV. e) ( ) III e IV. 02. A tabela a seguir representa os valores de 0solubilidade de uma determinada substância X em H2O, em função da temperatura. Misturou-se 180g de X com 500g de H20, a 30 ° C. O sistema foi, então, resfriado para 100° C. a massa do corpo de fundo, em gramas, formada foi de: C.S (Coeficiente de Solubilidade) Ba(NO3)2/40° C = 70g / 100g de H2O. A menor massa de água, a 40° C, necessária para solubilizar por completo 14g de nitrato de bário é: a) ( b) ( c) ( d) ( e) ( ) 10g. ) 20g. ) 30g. ) 40g. ) 50g. 04. Dissolvendo-se 7,4g de Ca(OH)2 em água suficiente para 500 mL de solução, obtém-se uma concentração, em mol/L, igual a: a) ( b) ( c) ( d) ( e) ( ) 0,1. ) 0,2. ) 0,3. ) 0,4. ) 0,5. 05. A massa de NaNO3, em gramas, que deve ser pesada de modo a obter 200 mL de solução 0,5 M é: a) ( ) 0,085 b) ( ) 0,85 01 c) ( ) 8,5 d) ( ) 85,0 e) ( ) 850,0 06. Uma solução que apresenta 40% em massa de soluto e densidade 1,2g/cm 3 tem concentração comum igual a: a) ( b) ( c) ( d) ( e) ( ) 120. ) 240. ) 360. ) 480. ) 600. concentração final dessa nova solução é: a) ( b) ( c) ( d) ( e) ( ) o triplo da concentração inicial. ) o dobro da concentração inicial. ) a metade da concentração inicial. ) um oitavo da concentração inicial. ) um quarto da concentração inicial. Anotações 07. Uma solução foi obtida dissolvendo-se 9,5g de MgCl2 para 200 mL de solução. A concentração, em mol/L, de íons cloreto nessa solução é igual a: a) ( b) ( c) ( d) ( e) ( ) 0,15. ) 0,25. ) 0,5. ) 0,75. ) 1,0. 08. Dissolvendo-se 3,42g de açúcar em xícara de café de 30 mL, a concentração em g/L será de: a) ( b) ( c) ( d) ( e) ( ) 0,114. ) 1,14 ) 11,4 ) 114,0 ) 1140,0 09.Considere uma solução de hidróxido de sódio 1,5 mol/L que deve ser misturada a 300 mL de uma solução a 2 mol/L da mesma base, a fim de torná-la solução 1,8 mol/L. Nesse caso, o volume – em mL – dessa solução de hidróxido de sódio deve ser igual a: a) ( b) ( c) ( d) ( e) ( ) 100. ) 200. ) 300. ) 400. ) 500. 10. Um técnico de laboratório dobra o volume de uma solução utilizando apenas solvente. A 02
Download